연구동향
개발(R&D) 가치가 가장 높은 “신약 R&D Project Top 10” 선정 (Evalute Pharma)
작성자
관리자
작성일
2024-02-07 15:14
조회
594
2023년 9월, 글로벌 제약·바이오 시장분석 전문기관인 피어스 바이오텍(Fierce Biotech)은 이벨류에이트 파마(Evaluate Pharma)의 2023년 연례보고서를 바탕으로 전 세계에서 개발가치가 가장 높을 것으로 예상되는 ‘신약 파이프라인 TOP 10’을 선정하여 발표한 바 있다 (바로가기). 2023년 12월, 이벨류에이트 파마(Evaluate Pharma)는 2024년 연례보고서(바로가기)에서 지난 9월의 자료를 업데이트하여 순현재가치(Net Present Value) 기준 개발가치가 가장 높은 ‘신약 R&D Project Top 10’을 선정하였다.
지난 9월의 자료와 비교하면 Cagrisema(비만치료), Tiragolumab(항암제), Aficamten(심장질환) 등 3건이 유지되었고 Orforglipron(비만/당뇨치료), Vanzacaftor(섬유증치료), Camizestrant(항암제), Giredestrant(항암제), Evobrutinib(다발성경화증치료), Nipocalimab(근무력증치료), VX-548(비마약성 진통제) 등 7건이 새로 Top 10에 포함되었다.
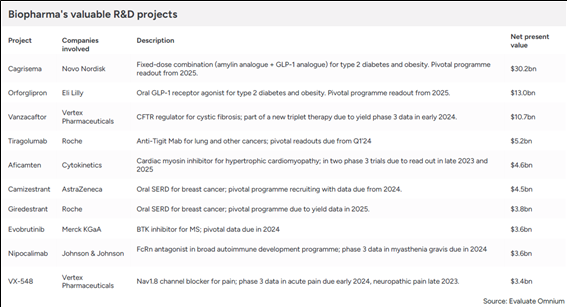
TOP 10에 선정된 약물들을
적응증(타깃질환)별로 보면: 항암제 3건, 비만/당뇨 2건, 심장질환, 근무력증, 낭포성 섬유증, 다발성 경화증, 비마약성 진통제 등이 각각 1건으로 나타났으며
약물유형(modality)별로 보면: 저분자 화합물 신약 7건, 항체신약 2건 및 펩타이드 신약 1건으로 구성되어 있다.
TOP 10에 선정된 약물들의 상세한 적응증, 구조 및 작용기전을 소개한다.
적응증: 비만치료 (Obesity)
순현재가치(Net present value): $30.2bn(302억 달러)
개발단계: Phase 3
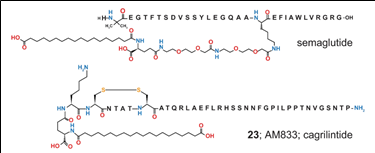
작용기전 & 약물유형: Long-acting amylin 유사체인 Cagrilintide(stable, lipidated long-acting amylin analogue)와 once-weekly GLP-1R 효능제인 Semaglutide 병용 약물.
미국당뇨병학회 연례학술대회(ADA 2023)에서 공개된 2형 당뇨병에 대한 임상2상 결과, Cagrilintide와 Semaglutide 복합제인 카그리세마(CagriSema)를 사용한 치료효과가 각 약물을 단독으로 사용한 치료효과보다 혈당개선과 체중감소 효과가 우수하다는 것이 확인되었다.
카그리세마는 당뇨병이 없는 과체중 또는 비만 환자 대상 임상2상에서 의미 있는 체중 감량 효과를 입증했을 뿐만 아니라 세마글루타이드보다 체중을 더 줄이는 것으로 조사됐다.
32주째 평균 체중감소량 : CagriSema군 15.6%로 Semaglutide 단독 (5.1%), Cagrilintide 단독 (8.1%)보다 체중감소 효과가 우수함. CagriSema군의 체중 10% 이상 감소 도달률은 71%였다 (바로가기).
약물구조(바로가기)
적응증: 비만 & 당뇨치료 (Obesity & Type 2 diabetes)
순현재가치(Net present value): $13.0bn(130억 달러)
개발단계: Phase 3
작용기전 & 약물유형: 뛰어난 체중감소 효과 때문에 현재 전세계적으로 돌풍을 일으키고 있는 비만/당뇨치료제인 위고비(주성분 Semaglutide. 비만치료제 상품명: Wegovy, 당뇨치료제 상품명: Ozempic)와 마운자로(주성분 Tirzepatide. 비만치료제 상품명: Zepbound, 당뇨치료제 상품명: Mounjaro)는 모두 incretin 호르몬의 일종인 GLP-1 (glucagon-like peptide-1) 유사체로 37~39개의 아미노산으로 구성된 펩타이드 약물이다. (바로가기)
Incretin 호르몬인 GLP-1은 음식물을 섭취하면 소장에서 분비되며 섭취한 당(glucose)의 농도의존적으로 인슐린 분비를 촉진하고, 뇌에서 포만감을 증가시켜 식욕을 억제하며, 위에서의 소화를 지연시켜 당뇨를 낮추며 동시에 체중을 감소시키는 작용을 한다.
이들 약제는 탁월한 비만/당뇨 치료 효과에도 불구하고 몇가지 단점이 있다. (1) 이들은 펩타이드 약제이기 때문에 경구투여는 불가능하고 주사제(Pre-filled Pin)로 주 1회 투여해야 하며, (2) 37~39개의 아미노산과 반감기를 높이기 위한 긴사슬 곁가지를 가지는 구조의 펩타이드 약제는 합성이 용이하지 않기 때문에 전세계적으로 공급이 수요를 따라가지 못하여 품귀 현상을 빚고 있으며 또한 약가도 비싼 편이다. (위고비 한달 투약비용 약 1,350불 (약 180만원)).
이러한 펩타이드 약제의 단점을 극복하기 위하여 복용 편이성이 높은 경구로 투여가능하고 합성(제조)경비가 비싸지 않은 저분자 화합물 GLP-1R 효능제(agonist)의 개발 필요성이 꾸준하게 대두되었고 최근 화이자(Pfizer)와 릴리(Eli Lilly)에서 각각 높은 활성을 가지는 저분자 GLP-1R 효능제 화합물을 개발하여 임상 2상 결과를 발표하였다(바로가기). 개발된 저분자 화합물 약제는 경구투여가 가능하면서도 기존의 펩타이드 약제와 유사한 당뇨/비만 치료효과를 보였으며 이중 릴리의 화합물(orforglipron)은 최근 임상3상 시험을 시작하였다.
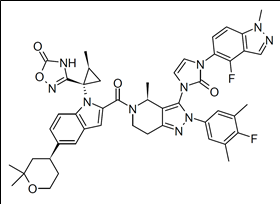
올포글리프론(Orforglipron)의 화학구조
Orforglipron의 비만 임상 2상 결과 (바로가기)
Daily Oral GLP-1 Receptor Agonist Orforglipron for Adults with Obesity
Orforglipron의 당뇨 임상 2상 결과 (바로가기)
Efficacy and safety of oral orforglipron in patients with type 2 diabetes: a multicentre, randomised, dose-response, phase 2 study
적응증: 낭포성 섬유증 (Cystic Fibrosis)
순현재가치(Net present value): $10.7bn(107억 달러)
개발단계: Phase 3
작용기전 & 약물유형: 낭포성 섬유증(cystic fibrosis)은 유전자에 결함이 생겨 나타나는 질환으로 주로 폐와 소화기관에 영향을 미치는 질환이다. 기관지 안에 있는 점액 분비선에 영향을 주어 비정상적으로 진하고 끈적끈적한 점액이 만들어지며 이로 인하여 기도 폐쇄와 기관지의 만성적 폐쇄가 야기되고, 세균 번식을 촉진시켜 염증을 유발한다. 또한 음식물을 분해하고 흡수하는 췌장 소화효소의 분비를 방해하여 소화를 어렵게 하고 영양분의 흡수에 장애를 일으킨다.
버텍스는 낭포성 섬유증에 강점을 가진 전문 바이오텍으로 이미 낭포성 섬유증에 대해 4개의 FDA 승인 신약을 가지고 있으며 차기 낭포성 섬유증 치료제로 3종의 약제를 (“Vanza triple” : Vanzacaftor + tezacaftor + deutivacaftor) 혼합한 3중 치료제(combination therapy)를 개발하고 있다.
2024년 2월에 발표된 “Vanza triple”의 임상 3상 결과는 효능과 부작용 모두 positive 하였으며 버텍스는 2024년 중반경에 6세 이상의 낭포성 섬유증 환자 치료에 대해 FDA 우선심사(priority review) 허가 신청을 할 것이라고 발표하였다(바로가기).
Vanza triple (Vanzacaftor + tezacaftor + deutivacaftor) 약물구조
Vanzacaftor: modulator of cystic fibrosis transmembrane conductance regulator (CFTR) for researching cystic fibrosis
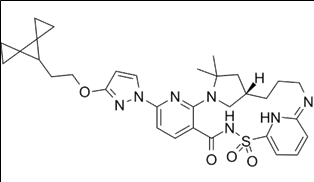
Tezacaftor: corrector to help the folding and presentation of the CFTR protein to the cell surface, which improves its function for individuals with a F508del mutation.
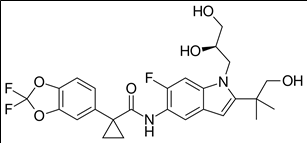
Deutivacaftor(CTP-656, VX561): cystic fibrosis transmembrane conductance regulator (CFTR) channel activator potentially for the treatment of cystic fibrosis.
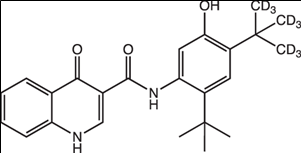
적응증: 면역관문억제 항암제 (immune checkpoint inhibitor)
순현재가치(Net present value): $5.2bn (52억 달러)
개발단계: Phase 3
작용기전 & 약물유형: 면역관문억제(immune checkpoint inhibitor) 항암제. 면역관문억제제는 암세포가 면역체계의 공격을 피하도록 돕는 단백질을 차단하여 암세포의 성장을 억제하는 약물이다. 티라골루맙은 억제성 면역관문인 TIGIT(T cell immunoglobulin and ITIM domain)에 결합하여 TIGIT의 기능을 차단하는 단일 항체(humanized IgG1/kappa monoclonal antibody that binds TIGIT)이다. TIGIT는 암세포의 표면에 발현되는 단백질로, 면역세포가 암세포를 공격하는 것을 방해한다. 티라골루맙은 TIGIT의 기능을 차단하여 면역세포가 암세포를 공격하는 것을 돕는다.
티라골루맙(tiragolumab)은 로슈의 차세대 면역항암제 후보로 많은 투자와 기대를 받았던 약물이이지만 티라골루맙은 로슈가 주력하고 있던 폐암 적응증에서 한동안 유의미한 결과를 내지 못했다. 티라골루맙은 2022년 미국임상종양학회 연례학술대회(ASCO 2022)에서 발표된 자료에 의하면 비소세포폐암, 확장기 소세포폐암에서 무진행생존기간(PFS)과 전체생존율(OS)이 모두 대조군과의 차이를 보여주지 못해 효과 입증에 실패한 바 있다.
그러나 미국 임상종양학회(ASCO 2023)에서 티라골루맙(tiragolumab)은 간암 초기 임상(1b/2)에서 기존 간암 표준치료 약물인 티쎈트릭(Tecentriq: Atezolizumab)과 아바스틴(Avastin: Bevacizumab)의 병용 요법을 통해 환자 객관적 반응률(ORR) 42.5%를 달성한 결과를 발표하였다. 이는 기존 치료법의 ORR인 15%를 크게 상회하는 결과이다. 무진행생존기간(PFS)도 대조군 대비 6.9개월이 개선된 11.1개월로 환자 사망위험을 58% 낮췄다.
티라골루맙은 아직 개발 초기 단계에 있지만, 암 치료의 새로운 패러다임을 제시할 것으로 기대되고 있다.
적응증: 비대성 심근병증 (Hypertrophic Cardiomyopathy)
순현재가치(Net present value): $4.6bn (46억 달러)
개발단계: Phase 3
작용기전: 아피캄텐(aficamten)은 비대성 심근병증(HCM: Hypertrophic Cardiomyopathy) 치료를 위하여 개발중인 경구용 약물이다. 비대성 심근병증(HCM)은 좌심실 대동맥판 협착증이나 고혈압과 같은 다른 증세 없이 비정상적으로 좌심실벽이 두꺼워져 심장박출 기능이 제한되는 질환이다. 비대성 심근병증 치료제로는 지난해 2022년 4월 승인을 받은 BMS의 캄지오스(Camzyos, 성분명: Mavacamten)가 있다.
아피캄텐(aficamten)은 캄지오스(Camzyos)와 유사하게 심장 내에서 마이오신(myosin, 심장 근육 세포의 수축을 유도하는 단백질)을 저해하는 작용기전을 가진다. 마이오신 단백질과 근육을 구성하는 단백질인 액틴의 과도한 교차결합 형성을 억제해 심근의 수축 및 좌심실 비대증을 감소시키는 작용을 한다.
2023년 12월에 발표된 아피캄텐(aficamten)의 임상 3상(SEQUOIA-HCM 시험)에서 위약대비 1차, 2차 종결점을 충족하고 운동능력을 유의미하게 개선한 고무적이고 긍정적인 주요결과들을 공개했다. 1차 종결점인 치료 24주차 심폐운동능력검사(CPET)로 측정한 최대산소섭취량(pVO2)은 아피캄텐군이 위약 대비 1.74mL/kg/min 차이를 보이며 임상적, 통계적으로 유의미하게 운동 능력을 개선했다. 아울러 주요 2차 종결점으로 설정한 치료 12주 및 24주차 삶의질 지표(KCCQ-CSS), 심근병증 설문지 점수, 심부전 심각도지표(NYHA), 좌심실 유출관(LVOT-G) 구배 변화 등 10가지 모두를 유의미하게 개선하였다.
아피캄텐이 시장에 출시되면 BMS의 캄지오스와 해당 질환 영역에서 경쟁이 펼쳐질 것으로 예상되고 있다.
아피캄텐(aficamten)의 약물구조
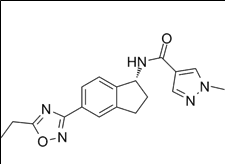
적응증: 유방암 (Breast Cancer)
순현재가치(Net present value): $4.5bn (45억 달러)
개발단계: Phase 3
작용기전: 카미제스트란트(camizestrant)는 경구용 선택적 에스트로겐 수용체 분해제(SERD, Selective Estrogen Receptor Degrader)로 차세대 유방암 치료제로 개발되고 있다.
유방암을 유발하는 주요 요인은 HER2 단백질과 여성호르몬인 에스트로겐(HR)이다. HR+/HER2- 유방암은 유방암 세포에 에스트로겐 수용체(ER: Estrogen Receptor)가 있지만 HER2 단백질이 발현되지 않는 유방암으로, 전체 유방암의 70%에서 에스트로겐 수용체가 발견된다.
폐경 이후 HR+/HER2- 유방암에 대한 표준 치료법은 내분비요법 중 하나인 아로마타제(aromatase, tamoxifen) 억제제를 사용하는 것이다. 하지만, 에스트로겐 수용체를 코딩하는 ESR1 유전자에 돌연변이가 발생하면 내분비요법에 반응하지 않는다. 진행성 또는 전이성 유방암의 최대 40%에서 ESR1 변이가 검출된다.
SERD 계열 약물은 내분비요법에 불응하는 재발성 HR+ 유방암에 사용되는 약물로, ESR1 변이 여부와 무관하게 ER의 분해를 유도해 유방암 세포로 끌어들이는 수용체의 생성을 억제하는 기전으로 작용한다.
2022년 2월 발표된 카미제스트란트의 ER+/HER2- 재발성 또는 전이성 유방암 환자 240명을 대상으로 진행한 임상 2상(SERENA-2) 연구에서 대조 약제인 Faslodex(성분명 Fulvestrant) 대비 무진행 생존 기간 (PFS: progressive-free survival) 이점을 입증하며 1차 목표점을 충족했다. 아스트라제네카는 카미제스트란트와 CDK4/6 억제제 병용요법의 효능과 안전성을 평가하기 위한 임상 3상(SERENA-4) 연구를 진행 중이다.
카미제스트란트(Camizestrant) 약물구조
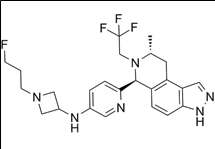
적응증: 유방암 (Breast Cancer)
순현재가치(Net present value): $3.8bn (38억 달러)
개발단계: Phase 3
작용기전: 지레데스트란트(Giredestrant)는 ER+/HER- 전이성 유방암 환자를 위한 선택적 에스트로겐 수용체 분해제 (SERD: Selective estrogen receptor downregulator)로 AstraZeneca가 개발중인 상기 6.카미제스트란트(camizestrant)와 적응증 및 작용기전이 거의 동일하다. 두 약물의 화학구조도 매우 유사하다.
SERD계열 약물은 에스트로겐 수용체(ER)와 결합하여 ER을 선택적으로 분해해 에스트로겐이 유방암 세포로 유입하는 것을 차단하는 기전의 치료제다. 지레데스트란트는 경구용으로 개발되고 있다.
지레데스트란트(Giredestrant) 약물구조
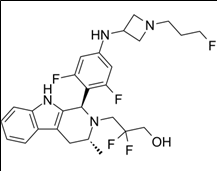
적응증: 다발성 경화증 (RMS: Relapsing Multiple Sclerosis)
순현재가치(Net present value): $3.6bn (36억 달러)
개발단계: Phase 3
작용기전: 다발성 경화증(RMS: Relapsing Multiple Sclerosis)은 바이러스 감염 혹은 유전적 요인에 의해 자신의 면역세포가 중추신경계(뇌와 척수신경) 여러 곳을 공격하여 다양한 신경손상 증상이 일으키는 진행성 중추신경계 질환이다.
에보브루티닙(Evobrutinib)은 선택적 BTK(Bruton’s tyrosine kinase) 제해제로 경구용 다발성 경화증 치료제로 머크에서 개발중인 약물이다. 그러나 머크는 2023년 12월, 에보브루티닙을 대조군 테리플루노미드(Teriflunomide, 상품명: Aubagio, 오마지오)와 재발성 다발성 경화증 환자 대상 재발률 감소효과를 비교평가한 2건의 임상 3상(EvolutionRMS 1 & EvolutionRMS 2)에서 1차 평가지표를 충족하지 못했다고 발표하였다..
EvolutionRMS 1 및 EvolutionRMS 2 등 2건의 임상 3상에서 연간 재발율은 위약대비 전자의 임상에서 0.11: 0.11건, 오마지오(Aubagio, 성분명: Teriflunomide)와 비교한 후자임상에서는 0.15:0.14건 등으로 이점제시에 실패했다. 앞서 FDA는 지난 2023년 4월 간손상 위험을 우려해 에보브루티닙 임상관련 신규환자의 등록을 제한 한 바 있다. 즉 부작용 이슈가 있는가 여부가 주요 관심사였으나 아예 대조군 대비 효과를 보여주지 못했다.
에보브루티닙(Evobrutinib) 약물구조
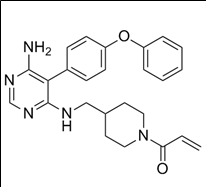
적응증: 전신성 중증 근무력증 (Myasthenia gravis)
순현재가치(Net present value): $3.6bn (36억 달러)
개발단계: Phase 3
작용기전 및 약물유형: 중증 근무력증(Myasthenia gravis)은 신경근접합부(neuromuscular junction)에 이상이 발생하는 자가면역 질환으로 신경의 자극이 근육으로 제대로 전달되지 못하면서 근육이 쉽게 피로해지는 질환이다. 신경의 자극이 신경 말단부에서 아세틸콜린(acetylcholine)을 방출하면 아세틸콜린이 근막 종판에 위치하는 아세틸콜린 수용체(AchR)와 결합하면서 근섬유가 활성화되고 근수축이 나타난다. 그러나 중증 근무력증에서는 아세틸콜린 수용체(AchR)에 대한 자기 항체가 아세틸콜린 수용체의 기능을 차단하거나 형태를 변형 혹은 파괴함으로써 근수축이 제대로 일어나지 않는다. 중증 근무력증은 평생 지속되고 고도로 쇠약하게 만드는 희귀 만성 자가항체 기반 신경근육질환이며 변동성 근육 약화를 특징으로 한다.
존슨앤존슨(J&J)의 제약부문 얀센(Janssen)이 자가면역질환 분야에서 차기 블록버스터 기대주로 개발하고 있는 니포칼리맙(Nipocalimab)은 항FcRn 단클론 항체 약물(anti-FcRn monoclonal antibody)이다. FcRn은 세포 안에서 자가항체인 면역글로불린(IgG)과 알부민 재활용에 관여하는 수용체로 세포 내로 들어온 IgG는 FcRn과 결합하면 리소좀에 분해되지 않고 세포 밖으로 방출되어 재활용된다. 니포칼리맙(Nipocalimab)은 FcRn과 IgG의 결합을 방해하여 IgG는 분해되어 혈중 농도가 감소하게 된다. (Nipocalimab is an investigational, high-affinity, fully human, aglycosylated, effectorless, monoclonal antibody that aims to selectively block FcRn to reduce levels of circulating immunoglobulin G (IgG) antibodies)
이 약물은 지난 2020년 얀센이 미국 모멘타 파마슈티컬스(Momenta Pharmaceuticals)를 65억 달러에 인수하면서 확보한 것이다.
2024년 2월에 발표된 성인 전신 중증근무력증(gMG) 환자를 대상으로 평가하는 주요 임상 3상 시험(VIVACITY)에서 니포칼리맙은 22~24주 동안 중증 근무력증-일상생활활동(MG-ADL) 점수를 위약 대비 통계적으로 유의하게 감소시킨 것으로 나타나 일차 평가지표를 충족했다.
니포칼리맙은 전신 중증 근무력증 외에도 쇼그렌 증후군(SjD: Sjögren’s disease), 태아신생아 용혈성 질환, 류마티스 관절염 등 자가항체 기반 질환 4개에 대해 임상적 효과를 입증했다.
적응증: 비마약성 진통제 (non-opioid, analgesic)
순현재가치(Net present value): $3.4bn (34억 달러)
개발단계: Phase 3
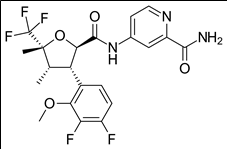
작용기전 및 약물유형: Suzetrigine(VX-548)은 말초 신경계의 통증 신호전달에 중요한 역할을 하는 나트륨채널(NaV1.8)을 선택적으로 억제해 통증이 퍼지는 것을 막는 기전을 가진 경구용 약물이다. VX-548은 2023년 12월에 발표된 당뇨병성 말초신경병증(diabetic peripheral neuropathy, DPN) 환자를 대상으로 진행한 임상2상에서 시판 신경병증 진통제 경쟁약물인 Pfizer의 라리카(Lyrica, 성분명: pregabalin) 대비 더 높은 통증 저감효과를 보였고, 2024년 1월에 발표된 중등도에서 중증의 급성 통증 치료를 위한 임상 3상 프로그램에서도 VX-548이 마약성 진통제인 비코딘(Vicodin; hydrocodone/acetaminophen)과 맞먹는 효과가 있다는 결과를 보였다. 이러한 결과를 바탕으로 버텍스는 올해 중반기에 미국 FDA에 신약 허가 신청서를 제출할 계획이다.
Suzetrigine(VX-548) 약물구조
지난 9월의 자료와 비교하면 Cagrisema(비만치료), Tiragolumab(항암제), Aficamten(심장질환) 등 3건이 유지되었고 Orforglipron(비만/당뇨치료), Vanzacaftor(섬유증치료), Camizestrant(항암제), Giredestrant(항암제), Evobrutinib(다발성경화증치료), Nipocalimab(근무력증치료), VX-548(비마약성 진통제) 등 7건이 새로 Top 10에 포함되었다.
<2024 Most Valuable R&D Project Top 10>

TOP 10에 선정된 약물들을
적응증(타깃질환)별로 보면: 항암제 3건, 비만/당뇨 2건, 심장질환, 근무력증, 낭포성 섬유증, 다발성 경화증, 비마약성 진통제 등이 각각 1건으로 나타났으며
약물유형(modality)별로 보면: 저분자 화합물 신약 7건, 항체신약 2건 및 펩타이드 신약 1건으로 구성되어 있다.
TOP 10에 선정된 약물들의 상세한 적응증, 구조 및 작용기전을 소개한다.
1. 카그리세마(CagriSema)
개발사: 노보 노디스크 (Novo Nordisk, 덴마크)적응증: 비만치료 (Obesity)
순현재가치(Net present value): $30.2bn(302억 달러)
개발단계: Phase 3
작용기전 & 약물유형: Long-acting amylin 유사체인 Cagrilintide(stable, lipidated long-acting amylin analogue)와 once-weekly GLP-1R 효능제인 Semaglutide 병용 약물.
미국당뇨병학회 연례학술대회(ADA 2023)에서 공개된 2형 당뇨병에 대한 임상2상 결과, Cagrilintide와 Semaglutide 복합제인 카그리세마(CagriSema)를 사용한 치료효과가 각 약물을 단독으로 사용한 치료효과보다 혈당개선과 체중감소 효과가 우수하다는 것이 확인되었다.
카그리세마는 당뇨병이 없는 과체중 또는 비만 환자 대상 임상2상에서 의미 있는 체중 감량 효과를 입증했을 뿐만 아니라 세마글루타이드보다 체중을 더 줄이는 것으로 조사됐다.
32주째 평균 체중감소량 : CagriSema군 15.6%로 Semaglutide 단독 (5.1%), Cagrilintide 단독 (8.1%)보다 체중감소 효과가 우수함. CagriSema군의 체중 10% 이상 감소 도달률은 71%였다 (바로가기).
약물구조(바로가기)

2. 올포글리프론(Orforglipron)
개발사: 릴리 (Eli Lilly, 미국)적응증: 비만 & 당뇨치료 (Obesity & Type 2 diabetes)
순현재가치(Net present value): $13.0bn(130억 달러)
개발단계: Phase 3
작용기전 & 약물유형: 뛰어난 체중감소 효과 때문에 현재 전세계적으로 돌풍을 일으키고 있는 비만/당뇨치료제인 위고비(주성분 Semaglutide. 비만치료제 상품명: Wegovy, 당뇨치료제 상품명: Ozempic)와 마운자로(주성분 Tirzepatide. 비만치료제 상품명: Zepbound, 당뇨치료제 상품명: Mounjaro)는 모두 incretin 호르몬의 일종인 GLP-1 (glucagon-like peptide-1) 유사체로 37~39개의 아미노산으로 구성된 펩타이드 약물이다. (바로가기)
Incretin 호르몬인 GLP-1은 음식물을 섭취하면 소장에서 분비되며 섭취한 당(glucose)의 농도의존적으로 인슐린 분비를 촉진하고, 뇌에서 포만감을 증가시켜 식욕을 억제하며, 위에서의 소화를 지연시켜 당뇨를 낮추며 동시에 체중을 감소시키는 작용을 한다.
이들 약제는 탁월한 비만/당뇨 치료 효과에도 불구하고 몇가지 단점이 있다. (1) 이들은 펩타이드 약제이기 때문에 경구투여는 불가능하고 주사제(Pre-filled Pin)로 주 1회 투여해야 하며, (2) 37~39개의 아미노산과 반감기를 높이기 위한 긴사슬 곁가지를 가지는 구조의 펩타이드 약제는 합성이 용이하지 않기 때문에 전세계적으로 공급이 수요를 따라가지 못하여 품귀 현상을 빚고 있으며 또한 약가도 비싼 편이다. (위고비 한달 투약비용 약 1,350불 (약 180만원)).
이러한 펩타이드 약제의 단점을 극복하기 위하여 복용 편이성이 높은 경구로 투여가능하고 합성(제조)경비가 비싸지 않은 저분자 화합물 GLP-1R 효능제(agonist)의 개발 필요성이 꾸준하게 대두되었고 최근 화이자(Pfizer)와 릴리(Eli Lilly)에서 각각 높은 활성을 가지는 저분자 GLP-1R 효능제 화합물을 개발하여 임상 2상 결과를 발표하였다(바로가기). 개발된 저분자 화합물 약제는 경구투여가 가능하면서도 기존의 펩타이드 약제와 유사한 당뇨/비만 치료효과를 보였으며 이중 릴리의 화합물(orforglipron)은 최근 임상3상 시험을 시작하였다.
올포글리프론(Orforglipron)의 화학구조

Orforglipron의 비만 임상 2상 결과 (바로가기)
Daily Oral GLP-1 Receptor Agonist Orforglipron for Adults with Obesity
Orforglipron의 당뇨 임상 2상 결과 (바로가기)
Efficacy and safety of oral orforglipron in patients with type 2 diabetes: a multicentre, randomised, dose-response, phase 2 study
3. 반자카프토르(Vanzacaftor)
개발사: 버텍스 (Vertex Pharmaceuticals, 미국)적응증: 낭포성 섬유증 (Cystic Fibrosis)
순현재가치(Net present value): $10.7bn(107억 달러)
개발단계: Phase 3
작용기전 & 약물유형: 낭포성 섬유증(cystic fibrosis)은 유전자에 결함이 생겨 나타나는 질환으로 주로 폐와 소화기관에 영향을 미치는 질환이다. 기관지 안에 있는 점액 분비선에 영향을 주어 비정상적으로 진하고 끈적끈적한 점액이 만들어지며 이로 인하여 기도 폐쇄와 기관지의 만성적 폐쇄가 야기되고, 세균 번식을 촉진시켜 염증을 유발한다. 또한 음식물을 분해하고 흡수하는 췌장 소화효소의 분비를 방해하여 소화를 어렵게 하고 영양분의 흡수에 장애를 일으킨다.
버텍스는 낭포성 섬유증에 강점을 가진 전문 바이오텍으로 이미 낭포성 섬유증에 대해 4개의 FDA 승인 신약을 가지고 있으며 차기 낭포성 섬유증 치료제로 3종의 약제를 (“Vanza triple” : Vanzacaftor + tezacaftor + deutivacaftor) 혼합한 3중 치료제(combination therapy)를 개발하고 있다.
2024년 2월에 발표된 “Vanza triple”의 임상 3상 결과는 효능과 부작용 모두 positive 하였으며 버텍스는 2024년 중반경에 6세 이상의 낭포성 섬유증 환자 치료에 대해 FDA 우선심사(priority review) 허가 신청을 할 것이라고 발표하였다(바로가기).
Vanza triple (Vanzacaftor + tezacaftor + deutivacaftor) 약물구조
Vanzacaftor: modulator of cystic fibrosis transmembrane conductance regulator (CFTR) for researching cystic fibrosis

Tezacaftor: corrector to help the folding and presentation of the CFTR protein to the cell surface, which improves its function for individuals with a F508del mutation.

Deutivacaftor(CTP-656, VX561): cystic fibrosis transmembrane conductance regulator (CFTR) channel activator potentially for the treatment of cystic fibrosis.

4. 티라골루맙(Tiragolumab)
개발사: 로슈 (Roche, 스위스)적응증: 면역관문억제 항암제 (immune checkpoint inhibitor)
순현재가치(Net present value): $5.2bn (52억 달러)
개발단계: Phase 3
작용기전 & 약물유형: 면역관문억제(immune checkpoint inhibitor) 항암제. 면역관문억제제는 암세포가 면역체계의 공격을 피하도록 돕는 단백질을 차단하여 암세포의 성장을 억제하는 약물이다. 티라골루맙은 억제성 면역관문인 TIGIT(T cell immunoglobulin and ITIM domain)에 결합하여 TIGIT의 기능을 차단하는 단일 항체(humanized IgG1/kappa monoclonal antibody that binds TIGIT)이다. TIGIT는 암세포의 표면에 발현되는 단백질로, 면역세포가 암세포를 공격하는 것을 방해한다. 티라골루맙은 TIGIT의 기능을 차단하여 면역세포가 암세포를 공격하는 것을 돕는다.
티라골루맙(tiragolumab)은 로슈의 차세대 면역항암제 후보로 많은 투자와 기대를 받았던 약물이이지만 티라골루맙은 로슈가 주력하고 있던 폐암 적응증에서 한동안 유의미한 결과를 내지 못했다. 티라골루맙은 2022년 미국임상종양학회 연례학술대회(ASCO 2022)에서 발표된 자료에 의하면 비소세포폐암, 확장기 소세포폐암에서 무진행생존기간(PFS)과 전체생존율(OS)이 모두 대조군과의 차이를 보여주지 못해 효과 입증에 실패한 바 있다.
그러나 미국 임상종양학회(ASCO 2023)에서 티라골루맙(tiragolumab)은 간암 초기 임상(1b/2)에서 기존 간암 표준치료 약물인 티쎈트릭(Tecentriq: Atezolizumab)과 아바스틴(Avastin: Bevacizumab)의 병용 요법을 통해 환자 객관적 반응률(ORR) 42.5%를 달성한 결과를 발표하였다. 이는 기존 치료법의 ORR인 15%를 크게 상회하는 결과이다. 무진행생존기간(PFS)도 대조군 대비 6.9개월이 개선된 11.1개월로 환자 사망위험을 58% 낮췄다.
티라골루맙은 아직 개발 초기 단계에 있지만, 암 치료의 새로운 패러다임을 제시할 것으로 기대되고 있다.
5. 아피캄텐(Aficamten)
개발사: 사이토키네틱스 (Cytokinetics, 미국)적응증: 비대성 심근병증 (Hypertrophic Cardiomyopathy)
순현재가치(Net present value): $4.6bn (46억 달러)
개발단계: Phase 3
작용기전: 아피캄텐(aficamten)은 비대성 심근병증(HCM: Hypertrophic Cardiomyopathy) 치료를 위하여 개발중인 경구용 약물이다. 비대성 심근병증(HCM)은 좌심실 대동맥판 협착증이나 고혈압과 같은 다른 증세 없이 비정상적으로 좌심실벽이 두꺼워져 심장박출 기능이 제한되는 질환이다. 비대성 심근병증 치료제로는 지난해 2022년 4월 승인을 받은 BMS의 캄지오스(Camzyos, 성분명: Mavacamten)가 있다.
아피캄텐(aficamten)은 캄지오스(Camzyos)와 유사하게 심장 내에서 마이오신(myosin, 심장 근육 세포의 수축을 유도하는 단백질)을 저해하는 작용기전을 가진다. 마이오신 단백질과 근육을 구성하는 단백질인 액틴의 과도한 교차결합 형성을 억제해 심근의 수축 및 좌심실 비대증을 감소시키는 작용을 한다.
2023년 12월에 발표된 아피캄텐(aficamten)의 임상 3상(SEQUOIA-HCM 시험)에서 위약대비 1차, 2차 종결점을 충족하고 운동능력을 유의미하게 개선한 고무적이고 긍정적인 주요결과들을 공개했다. 1차 종결점인 치료 24주차 심폐운동능력검사(CPET)로 측정한 최대산소섭취량(pVO2)은 아피캄텐군이 위약 대비 1.74mL/kg/min 차이를 보이며 임상적, 통계적으로 유의미하게 운동 능력을 개선했다. 아울러 주요 2차 종결점으로 설정한 치료 12주 및 24주차 삶의질 지표(KCCQ-CSS), 심근병증 설문지 점수, 심부전 심각도지표(NYHA), 좌심실 유출관(LVOT-G) 구배 변화 등 10가지 모두를 유의미하게 개선하였다.
아피캄텐이 시장에 출시되면 BMS의 캄지오스와 해당 질환 영역에서 경쟁이 펼쳐질 것으로 예상되고 있다.
아피캄텐(aficamten)의 약물구조

6. 카미제스트란트(Camizestrant)
개발사: 아스트라제네카 (AstraZeneca, 영국)적응증: 유방암 (Breast Cancer)
순현재가치(Net present value): $4.5bn (45억 달러)
개발단계: Phase 3
작용기전: 카미제스트란트(camizestrant)는 경구용 선택적 에스트로겐 수용체 분해제(SERD, Selective Estrogen Receptor Degrader)로 차세대 유방암 치료제로 개발되고 있다.
유방암을 유발하는 주요 요인은 HER2 단백질과 여성호르몬인 에스트로겐(HR)이다. HR+/HER2- 유방암은 유방암 세포에 에스트로겐 수용체(ER: Estrogen Receptor)가 있지만 HER2 단백질이 발현되지 않는 유방암으로, 전체 유방암의 70%에서 에스트로겐 수용체가 발견된다.
폐경 이후 HR+/HER2- 유방암에 대한 표준 치료법은 내분비요법 중 하나인 아로마타제(aromatase, tamoxifen) 억제제를 사용하는 것이다. 하지만, 에스트로겐 수용체를 코딩하는 ESR1 유전자에 돌연변이가 발생하면 내분비요법에 반응하지 않는다. 진행성 또는 전이성 유방암의 최대 40%에서 ESR1 변이가 검출된다.
SERD 계열 약물은 내분비요법에 불응하는 재발성 HR+ 유방암에 사용되는 약물로, ESR1 변이 여부와 무관하게 ER의 분해를 유도해 유방암 세포로 끌어들이는 수용체의 생성을 억제하는 기전으로 작용한다.
2022년 2월 발표된 카미제스트란트의 ER+/HER2- 재발성 또는 전이성 유방암 환자 240명을 대상으로 진행한 임상 2상(SERENA-2) 연구에서 대조 약제인 Faslodex(성분명 Fulvestrant) 대비 무진행 생존 기간 (PFS: progressive-free survival) 이점을 입증하며 1차 목표점을 충족했다. 아스트라제네카는 카미제스트란트와 CDK4/6 억제제 병용요법의 효능과 안전성을 평가하기 위한 임상 3상(SERENA-4) 연구를 진행 중이다.
카미제스트란트(Camizestrant) 약물구조

7. 지레데스트란트(Giredestrant)
개발사: 로슈 (Roche, 스위스)적응증: 유방암 (Breast Cancer)
순현재가치(Net present value): $3.8bn (38억 달러)
개발단계: Phase 3
작용기전: 지레데스트란트(Giredestrant)는 ER+/HER- 전이성 유방암 환자를 위한 선택적 에스트로겐 수용체 분해제 (SERD: Selective estrogen receptor downregulator)로 AstraZeneca가 개발중인 상기 6.카미제스트란트(camizestrant)와 적응증 및 작용기전이 거의 동일하다. 두 약물의 화학구조도 매우 유사하다.
SERD계열 약물은 에스트로겐 수용체(ER)와 결합하여 ER을 선택적으로 분해해 에스트로겐이 유방암 세포로 유입하는 것을 차단하는 기전의 치료제다. 지레데스트란트는 경구용으로 개발되고 있다.
지레데스트란트(Giredestrant) 약물구조

8. 에보브루티닙(Evobrutinib)
개발사: 머크 (Merck, 독일)적응증: 다발성 경화증 (RMS: Relapsing Multiple Sclerosis)
순현재가치(Net present value): $3.6bn (36억 달러)
개발단계: Phase 3
작용기전: 다발성 경화증(RMS: Relapsing Multiple Sclerosis)은 바이러스 감염 혹은 유전적 요인에 의해 자신의 면역세포가 중추신경계(뇌와 척수신경) 여러 곳을 공격하여 다양한 신경손상 증상이 일으키는 진행성 중추신경계 질환이다.
에보브루티닙(Evobrutinib)은 선택적 BTK(Bruton’s tyrosine kinase) 제해제로 경구용 다발성 경화증 치료제로 머크에서 개발중인 약물이다. 그러나 머크는 2023년 12월, 에보브루티닙을 대조군 테리플루노미드(Teriflunomide, 상품명: Aubagio, 오마지오)와 재발성 다발성 경화증 환자 대상 재발률 감소효과를 비교평가한 2건의 임상 3상(EvolutionRMS 1 & EvolutionRMS 2)에서 1차 평가지표를 충족하지 못했다고 발표하였다..
EvolutionRMS 1 및 EvolutionRMS 2 등 2건의 임상 3상에서 연간 재발율은 위약대비 전자의 임상에서 0.11: 0.11건, 오마지오(Aubagio, 성분명: Teriflunomide)와 비교한 후자임상에서는 0.15:0.14건 등으로 이점제시에 실패했다. 앞서 FDA는 지난 2023년 4월 간손상 위험을 우려해 에보브루티닙 임상관련 신규환자의 등록을 제한 한 바 있다. 즉 부작용 이슈가 있는가 여부가 주요 관심사였으나 아예 대조군 대비 효과를 보여주지 못했다.
에보브루티닙(Evobrutinib) 약물구조

9. 니포칼리맙(Nipocalimab)
개발사: 존슨&존슨 (Johnson & Johnson, 미국)적응증: 전신성 중증 근무력증 (Myasthenia gravis)
순현재가치(Net present value): $3.6bn (36억 달러)
개발단계: Phase 3
작용기전 및 약물유형: 중증 근무력증(Myasthenia gravis)은 신경근접합부(neuromuscular junction)에 이상이 발생하는 자가면역 질환으로 신경의 자극이 근육으로 제대로 전달되지 못하면서 근육이 쉽게 피로해지는 질환이다. 신경의 자극이 신경 말단부에서 아세틸콜린(acetylcholine)을 방출하면 아세틸콜린이 근막 종판에 위치하는 아세틸콜린 수용체(AchR)와 결합하면서 근섬유가 활성화되고 근수축이 나타난다. 그러나 중증 근무력증에서는 아세틸콜린 수용체(AchR)에 대한 자기 항체가 아세틸콜린 수용체의 기능을 차단하거나 형태를 변형 혹은 파괴함으로써 근수축이 제대로 일어나지 않는다. 중증 근무력증은 평생 지속되고 고도로 쇠약하게 만드는 희귀 만성 자가항체 기반 신경근육질환이며 변동성 근육 약화를 특징으로 한다.
존슨앤존슨(J&J)의 제약부문 얀센(Janssen)이 자가면역질환 분야에서 차기 블록버스터 기대주로 개발하고 있는 니포칼리맙(Nipocalimab)은 항FcRn 단클론 항체 약물(anti-FcRn monoclonal antibody)이다. FcRn은 세포 안에서 자가항체인 면역글로불린(IgG)과 알부민 재활용에 관여하는 수용체로 세포 내로 들어온 IgG는 FcRn과 결합하면 리소좀에 분해되지 않고 세포 밖으로 방출되어 재활용된다. 니포칼리맙(Nipocalimab)은 FcRn과 IgG의 결합을 방해하여 IgG는 분해되어 혈중 농도가 감소하게 된다. (Nipocalimab is an investigational, high-affinity, fully human, aglycosylated, effectorless, monoclonal antibody that aims to selectively block FcRn to reduce levels of circulating immunoglobulin G (IgG) antibodies)
이 약물은 지난 2020년 얀센이 미국 모멘타 파마슈티컬스(Momenta Pharmaceuticals)를 65억 달러에 인수하면서 확보한 것이다.
2024년 2월에 발표된 성인 전신 중증근무력증(gMG) 환자를 대상으로 평가하는 주요 임상 3상 시험(VIVACITY)에서 니포칼리맙은 22~24주 동안 중증 근무력증-일상생활활동(MG-ADL) 점수를 위약 대비 통계적으로 유의하게 감소시킨 것으로 나타나 일차 평가지표를 충족했다.
니포칼리맙은 전신 중증 근무력증 외에도 쇼그렌 증후군(SjD: Sjögren’s disease), 태아신생아 용혈성 질환, 류마티스 관절염 등 자가항체 기반 질환 4개에 대해 임상적 효과를 입증했다.
10. 수제트리진 (Suzetrigine, VX-548)
개발사: 버텍스 파마슈티컬스(Vertex Pharmaceuticals, 미국)적응증: 비마약성 진통제 (non-opioid, analgesic)
순현재가치(Net present value): $3.4bn (34억 달러)
개발단계: Phase 3
작용기전 및 약물유형: Suzetrigine(VX-548)은 말초 신경계의 통증 신호전달에 중요한 역할을 하는 나트륨채널(NaV1.8)을 선택적으로 억제해 통증이 퍼지는 것을 막는 기전을 가진 경구용 약물이다. VX-548은 2023년 12월에 발표된 당뇨병성 말초신경병증(diabetic peripheral neuropathy, DPN) 환자를 대상으로 진행한 임상2상에서 시판 신경병증 진통제 경쟁약물인 Pfizer의 라리카(Lyrica, 성분명: pregabalin) 대비 더 높은 통증 저감효과를 보였고, 2024년 1월에 발표된 중등도에서 중증의 급성 통증 치료를 위한 임상 3상 프로그램에서도 VX-548이 마약성 진통제인 비코딘(Vicodin; hydrocodone/acetaminophen)과 맞먹는 효과가 있다는 결과를 보였다. 이러한 결과를 바탕으로 버텍스는 올해 중반기에 미국 FDA에 신약 허가 신청서를 제출할 계획이다.
Suzetrigine(VX-548) 약물구조

작성: 이현규(한국화학연구원)
참고자료(바로가기): 2024 Preview (Evaluate Pharma)