연구동향
2023 New FDA Approved Drugs (May~June, 2023)
2023년 5월~6월 사이에 미국 FDA에서 판매허가를 받은 12종의 약물을 소개합니다.
2023년 1월~4월, 판매허가를 받은 14종의 약물에 대한 정보는 이곳 참조(바로가기)
- Pegunigalsidase alfa (Elfabrio), Recombinant human enzyme
- Fezolinetant (Veozah)
- Perfluorhexyloctane (Miebo)
- Epcoritamab-bysp (Epkinly), monoclonal antibody
- Sulbactam/durlobactam (Xacduro)
- Nirmatrelvir/Ritonavir (Paxlovid)
- Flotufolastat F-18 (Posluma), radioactive diagnostic agent
- Sotagliflozin (Inpefa)
- Glofitamab-gxbm (Columvi), monoclonal antibody
- Ritlecitinib (Litfulo)
- Rozanolixizumab-noli (Rystiggo), monoclonal antibody
- Somatrogon-ghla (Ngenla)
약물유형(Modality)
저분자화합물의약품 7종, 단일클론항체신약(monoclonal antibody) 3종, 조영제(radioactive diagnostic agent) 1종, 효소대체요법제 (recombinant human enzyme) 1종.
1. 성분명(제품명) : Pegunigalsidase alfa (Elfabrio)
개발사 : 프로탤릭스 바이오테라퓨틱스(Protalix BioTherapeutics) & 키에시(Chiesi Group)
적응증 : 희귀 유전성 대사 질환인 파브리병(Fabry disease) 치료. (파브리병 : 세포 내 소기관인 리소좀(lysosome)에서 당지질대사를 수행하는 특정효소의 이상으로 GL-3(globotriaosylceramide)라고 하는 당지질 물질이 우리 세포에 지속적으로 쌓이는, 이로 인해 다양한 기관이 서서히 손상되는 진행성 희귀난치질환)
작용기전 : 리소좀 내 소기관에서 특정 당지질 대사에 필요한 효소인 α-갈락토시다아제(α-galactosidase-A)가 결핍돼 혈관벽에서 당지질이 진행성으로 축적되어 조직과 기관의 기능이 손상되는 파브리병의 치료를 위하여 유전자 재조합 이용하여 효소합성 투여 (효소 대체 요법제)
약물유형 : 인체에 부족한 효소를 유전자 재조합 이용하여 합성 투여하는 효소 대체 요법제 (Recombinant human α-galactosidase-A)
2. 성분명(제품명) : Fezolinetant (Veozah)
개발사 : 아스텔라스제약 (Astellas Pharma)
적응증 : 비호르몬성 갱년기(폐경) 혈관운동증상 치료제 (treatment of moderate to severe vasomotor symptoms due to menopause)
작용기전 : 뇌에서 체온 조절에 중요한 역할을 하는 NK3 (neurokinin-3) 수용체와 결합해 그 활동을 차단 (orally active, selective neurokinin-3 receptor antagonist).
약물구조
3. 성분명(제품명) : Perfluorhexyloctane (Miebo)
개발사 : 바슈롬 (Bausch & Lomb)
적응증 : 안구건조증(Dry eye disease)의 징후 및 증상 치료를 위한 점안제
작용기전 : ‘마이봄샘 기능장애’ (meibomian gland dysfunction, MGD)에 의한 안구내 지질의 결핍 보충, 눈물증발 억제.
약물구조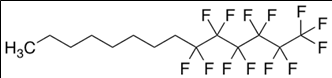
4. 성분명(제품명) : Epcoritamab-bysp (Epkinly)
개발사 : 애브비 & 젠맙 (Abbvie & Genmab)
적응증 : 재발성 또는 불응성 ‘미만성 거대 B세포 림프종’ (DLBCL: Diffuse large B-cell lymphoma)의 3차 치료제로 가속승인 (accelerated approval)
작용기전 : T-cell의 CD3와 B-cell의 CD20에 동시에 작용하여 T cell mediated killing of CD20+ cells 유도 (It works by simultaneously binding to CD3 on T-cells and CD20 on B-cells and induces T-cell mediated killing of CD20+ cells.)
약물유형 : CD20 x CD3 이중항체 (IgG1-bispecific antibody, bispecific CD20-directed CD3 T-cell engager)
5. 성분명(제품명) : Sulbactam/durlobactam (Xacduro)
개발사 : 이노비바 (Innoviva Specialty therapeutics)
적응증 : 세균성 폐렴 치료용 항생제, 주사제. 약물 저항이 높은 아시네토박터 바우마니 유발 원내 폐렴/인공호흡기 관련 폐렴(HABP/VABP) 감염 18세 이상 환자에 대해 허가.
작용기전 : 세균벽 생합성 저해 베타락탐 항생제인 sulbactam과 sulbactam을 베타락탐 분해효소로부터 보호해줄 수 있는 베타락탐 분해효소 저해제 (beta-lactamase inhibitor)인 durlobactam이 주사제로 함께 포장된 제품 (co-packaged product of sulbactam, a beta-lactam antibacterial and beta-lactamase inhibitor; and durlobactam, a beta-lactamase inhibitor)
약물구조 : sulbactam/durlobactam
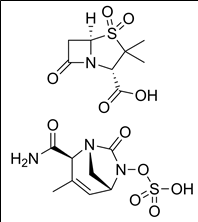
6. 성분명(제품명) : Nirmatrelvir/Ritonavir (Paxlovid)
개발사 : 화이자(Pfizer)
적응증 : 중증으로 진행될 위험이 높은 경증 및 중등증 코로나19 환자 치료를 위한 “경구용” 항바이러스제. 2021년 12월 긴급 사용승인 (EUA: emergency use authorization) 취득하였으며 2023년 5월 정식 사용승인을 취득함.
작용기전 : SARS-CoV-2의 복제에 필수적인 3CL-protease (main protease)를 저해하는 항바이러스제인 니르마트렐비르(nirmatrelvir)와 CYP3A에 의한 니르마트렐비르의 간 대사를 억제하는 리토나비르(ritonavir)로 구성.
약물구조 :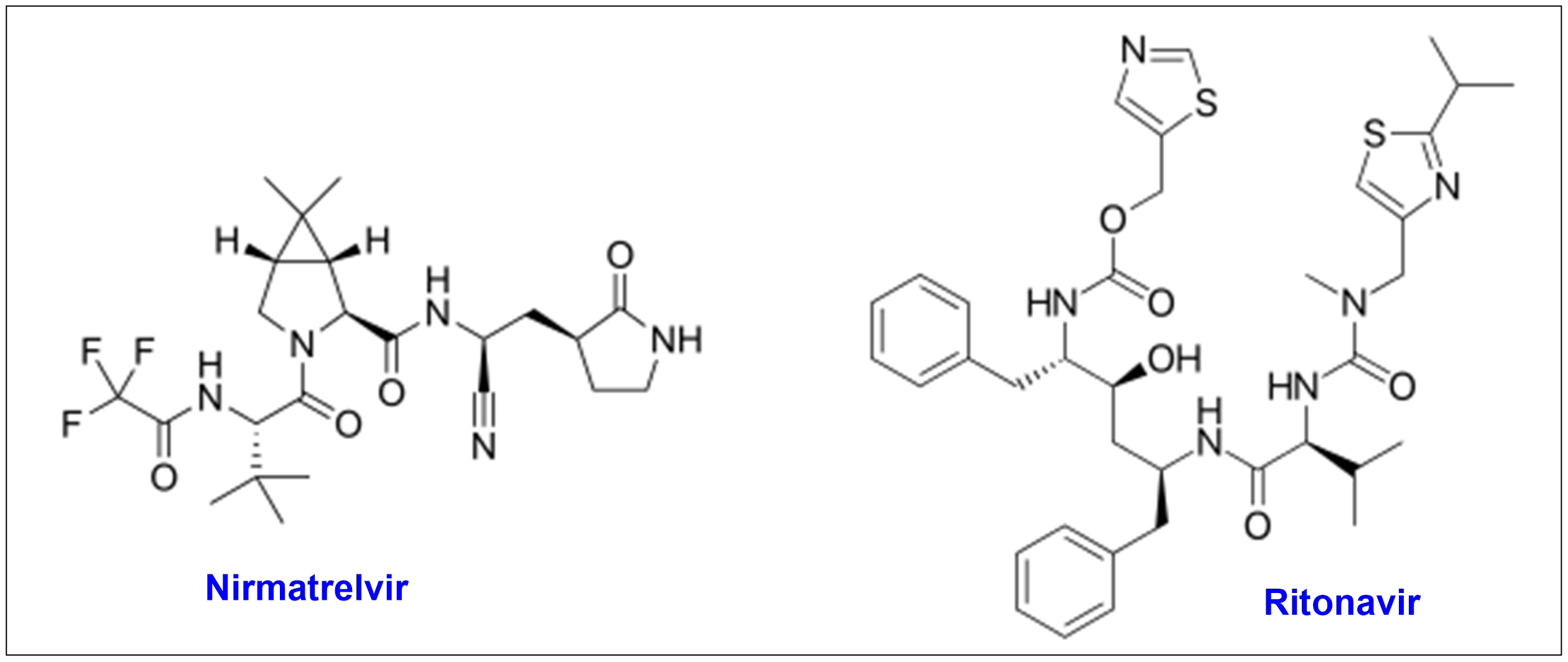
7. 성분명(제품명) : Flotufolastat F-18 (Posluma)
개발사 : 블루어스 다이애그노스틱스(Blue Earth Diagnostics)
적응증 : 전립선암 진단용 PET 조영제. 혈청 전립선특이항원(PSMA: prostate-specific membrane antigen) 수치가 전립선암의 전이나 재발이 의심될 경우에 양전자방출단층촬영(PET: Positron Emission Tomography) 식별을 위해 허가
작용기전 : 원발성 및 전이성 전립선암 세포의 90% 이상에서 과잉 발현되는 PSMA 단백질을 타깃으로 삼아 결합하는 F18-라벨 PET 조영제
약물구조 :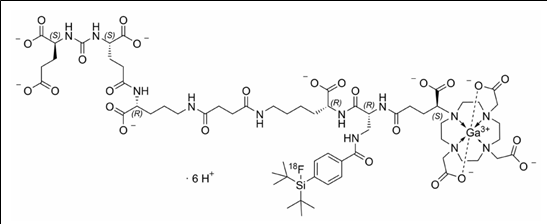
8. 성분명(제품명) : Sotagliflozin (Inpefa)
개발사 : 렉시콘 (Lexicon Pharmaceuticals)
적응증 : 심부전(heart failure) 치료. (2019년부터 1형, 2형 당뇨병을 적응증으로 진행한 FDA 승인신청이 연속 거부됨에 따라 일단 당뇨병은 건너뛰고 심부전을 적응증으로 먼저 FDA 승인받음)
작용기전 : SGLT 1/2 억제제 (dual sodium-dependent glucose transporter 1/2 inhibitor)
약물구조 :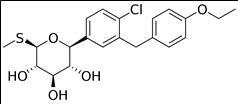
9. 성분명(제품명) : Glofitamab-gxbm (Columvi)
개발사 : Genentech (Roche)
적응증 : 재발성 또는 불응성 ‘미만성 거대 B세포 림프종’ (DLBCL: Diffuse large B-cell lymphoma)의 3차 치료제로 FDA 가속승인 (accelerated approval)
작용기전 : CD20×CD3 T세포 관여 이중 특이성 항체 (CD20-targeting T-cell engaging bispecific antibody that binds to the CD3 receptor expressed on the surface of T-cells and CD20 expressed on the surface of lymphoma cells and healthy B-lineage cells. In vitro, columvi activated T-cells, caused the release of proinflammatory cytokines, and induced lysis of B-cells.)
약물유형 : 이중 특이성 단일클론항체 (bispecific monoclonal antibody)
10. 성분명(제품명) : Ritlecitinib (Litfulo)
개발사 : 화이자(Pfizer)
적응증 : 12세 이상 청소년 및 성인 중증 원형탈모증 치료제
작용기전 : JAK3 저해 및 티로신키나제 억제 이중 기전 (irreversibly inhibits Janus kinase 3 (JAK3) and the tyrosine kinase expressed in hepatocellular carcinoma (TEC) kinase family, and inhibits cytokine induced STAT phosphorylation mediated by JAK3-dependent receptors.)
약물구조 :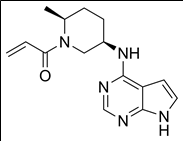
11. 성분명(제품명) : Rozanolixizumab-noli (Rystiggo)
개발사 : UCB
적응증 : 전신성 중증 근무력증 (generalized myasthenia gravis, gMG) 치료제
작용기전 : 신생 Fc 수용체 (neonatal FcRn)를 표적으로 작용하는 피하주사용 IgG4 단일클론항체. IgG4 자가항체가 전신성 중증 근무력증을 일으키므로 IgG4를 억제함으로써 질병 진행 차단.
약물유형 : IgG4 자가항체 억제하는 단일클론항체 피하 주사제
12. 성분명(제품명) : Somatrogon-ghla (Ngenla)
개발사 : 화이자(Pfizer) & 옵코헬스(OPKO Health)
적응증 : 뇌하수체에서 성장호르몬이 제대로 분비되지 않아 발생하는 희귀질환인 성장호르몬 결핍증으로 인한 소아 성장부진 치료제. (To treat growth failure due to inadequate secretion of endogenous growth hormone)
작용기전 : DNA 재조합 기술을 통해 반감기가 길어진 (Long-acting) 재조합 인간성장호르몬(rhGH), 주 1회 Prefilled Pen Injection.
약물유형 : 재조합 인간성장 성장호르몬(rhGH) 제제
작성: 이 현 규 (한국화합물은행)
참고자료(바로가기) US/ FDA : Novel Drug Approvals for 2023