연구동향
2023년 미국 FDA에서 판매 허가를 받은 신약 소개 (July ~ Aug, 2023)
작성자
관리자
작성일
2023-09-11 14:56
조회
1272
2023년 7월~8월 사이에 미국 FDA에서 판매 허가를 받은 9종의 신약을 소개합니다.
2023년 5월~6월 사이에 미국 FDA에서 판매 허가를 받은 12종의 신약에 대한 정보(바로가기)
2023년 1월~4월 사이에 미국 FDA에서 판매 허가를 받은 14종의 신약에 대한 정보(바로가기)
약물유형(Modality)
저분자화합물의약품 4종, 단일클론항체신약(monoclonal antibody) 4종, 압타머(Aptamer) 1종.
1. 성분명(제품명) : Nirsevimab-alip (Beyfortus)
개발사 : 아스트라제네카(AstraZeneca)
적응증 : 소아용 호흡기 세포융합 바이러스(RSV: Respiratory Syncytial Virus) 예방 항체. 60세 이상 고령자용 RSV 백신은 이미 승인되어 있으며 이번에는 24개월 이하 영유아의 RSV 하기도질환 예방 항체가 FDA의 승인됨.
작용기전 : 베이포투스는 백신과는 다른 예방항체. 백신은 백신을 주입해 신체의 면역체계가 항체를 만들도록 유도하는 기전으로 작용하는 반면 예방항체는 체내에 합성항체(monoclonal antibody)를 주사로 주입하여 바이러스와 결합해 세포를 감염시키지 못하게 하는 기전으로 작용.
약물유형 : Monoclonal antibody with activity against RSV
2. 성분명(제품명) : Vanflyta (quizartinib)
개발사 : 다이이찌산쿄 (Daiichi Sankyo)
적응증 : (FLT3-ITD 변이를 가진) 급성 골수성 백혈병(AML: Acute Myeloid Leukemia) 1차 치료제. AML은 성인에서 가장 흔하게 발병하는 백혈병이며 새로 진단된 AML 환자 중 최대 37%는 FLT3 유전자 변이가 있고 이 중 약 80%가 FLT3-ITD 변이임. 2019년 일본에서 먼저 승인되어 사용중. 그러나 유럽 의약청 EMA에서는 승인 거절됨.
작용기전 : Receptor Tyrosine Kinase III에 속하는 사이토카인 수용체(cytokine receptor)인 FLT3 억제 (경구용). FLT3 유전자는 혈액 내 세포 생산 과정을 조절하는 역할을 하는데, FLT3 변이는 혈액암 성장을 촉진해 재발 위험과 생존 기간을 줄인다. FLT3 변이 진단 검사도 함께 승인됨.
약물구조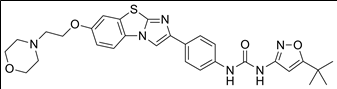
3. 성분명(제품명) : Lotilaner (Xdemvy)
개발사 : 미국 타서스 파마슈티컬스 (Tarsus Pharmaceuticals)
적응증 : 안구건조증을 유발하는 대표적인 원인 질환인 모낭충 진드기(Demodex mite)에 의한 안검염(눈꺼풀 및 눈꺼풀 테두리에 발생하는 염증) 치료 안약(점안액)
작용기전 : GABA-Cl channel을 차단해 모낭충 진드기 등 외부 기생충을 마비, 박멸시킴. 반려견의 진드기 치료제로도 사용되고 있는 약제를 사람의 안구에 투약 가능하도록 희석시킨 안약 (점안액)
약물구조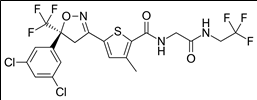
4. 성분명(제품명) : Zuranolone (Zurzuvae)
개발사 : 세이지 (Sage Therapeutics) & 바이오젠 (Biogen)
적응증 : 첫 경구용 산후우울증 치료제. 2주간 1일 1회 복용으로 우울 증상 빠르게 호전. 함께 신청된 주요우울장애(MDD: Major depressive disorder) 적응증은 허가 거절
작용기전 : 뇌 신경전달물질인 GABA-A 수용체 조절 (positive allosteric modulator of the GABA-A receptor)
약물구조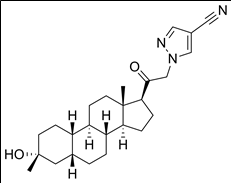
5. 성분명(제품명) : Avacincaptad pegol (Izervay)
개발사 : 아이베릭 바이오 (Iveric Bio). 아스텔라스 (Astellas Pharma)에 인수됨.
적응증 : 지도형 위축(Geographic Atropy: GA)을 동반한 노인성 황반변성(AMD) 치료제. 노인성 황반변성(AMD)은 망막의 중심부에 있는 시신경 조직인 황반에 노폐물(드루젠)이 쌓이거나 비정상적인 신생 혈관이 자라면서 황반이 손상돼 시야의 중심부를 보는 시력인 중심시(central vision)를 잃는 질환. 망막의 지도 모양 위축은 황반의 중심부가 손상되면서 망막세포가 사멸하는 현상으로 AMD 말기에 나타난다.
작용기전 : 면역시스템의 작용을 도와주는 C5보체(complement system) 단백질 저해제로 3상 임상시험에서 투여 12개월 후 지도 모양 위축의 진행을 35% 억제하는 효과를 나타냄. 안구내 주사제 (Intravitreal injection, IVT).
약물구조 : 39개 변형 nucleoside로 구성된 RNA 압타머(aptamer). RNA aptamer covalently bound to a branched polyethylene glycol (PEG) molecule.
6. 성분명(제품명) : Talquetamab-tgvs (Talvey)
개발사 : 존슨앤드존슨 (Janssen Pharmaceutical Companies of Johnson & Johnson)
적응증 : 재발성 또는 불응성 다발성 골수종 5차 치료제. 다발성 골수종은 골수에서 면역 항체를 만드는 형질 세포에서 발생하는 혈액암이다. 이번 허가는 가속 승인(Accelerated Approval) 제도를 통해 부여된 조건부 허가다. 따라서 얀센은 향후 임상 3상 시험에서 탈베이(Talvey)의 유효성 및 안전성을 확증해야 이 신약을 정식 허가로 전환할 수 있다.
작용기전 : T-세포 표면의 CD3 수용체와 골수종세포(multiple myeloma cell) 표면의 GPRC5D 수용체를 표적으로 하는 이중특이성(bispecific) 항체, T-cell engager.
약물유형 : CD3와 GPRC5D 표적으로 하는 이중특이성 항체 신약 (bispecific antibody).
7. 성분명(제품명) : Elranatamab-bcmm (Elrexfio)
개발사 : 화이자(Pfizer)
적응증 : (프로테아좀 억제제, 면역조절제제, 항-CD38 단클론항체를 포함해 적어도 4가지 치료를 받은) 재발 또는 불응성 다발골수종(multiple myeloma) 성인 환자의 치료제로 가속 승인(Accelerated Approval). 피하주사제(SC)형으로 주 1회 24주 치료
작용기전 : 골수종 세포의 B세포 성숙항원(BCMA)과 T세포의 CD3에 결합해 T세포를 활성화함에 따라 골수종세포의 사멸을 유도하는 작용을 하는 이중특이항체.
약물유형 : BCMA와 CD3 표적 이중특이항체
8. 성분명(제품명) : Palovarotene (Sohonos)
개발사 : 프랑스 제약사 입센(Ipsen)
적응증 : 진행성 골화성 섬유이형성증(FOP: Fibrodysplasia ossificans progressiva) 치료제. FOP는 결합조직에서 뼈가 계속 자라는 초희귀 유전성 골질환. EU 승인은 실패.
작용기전 : 경구용 선택적 레티노산 수용체 감마(Retinoic Acid Receptor Gamma, RARγ) 촉진제 (agonist).
약물구조
9. 성분명(제품명) : Pozelimab-bbfg (Veopoz)
개발사 : 리제네론 파마슈티컬스(Regeneron Pharmaceuticals)
적응증 : 초희귀 유전성 면역질환인 CD55-결핍 단백질 손실성 장질환인 채플병(CHAPLE diease: 전세계 환자수는 약 100명인 초희귀 질환) 치료제. 채플병은 CD55 유전자에 변이가 발생하여 면역계에 작용하는 혈청 안의 단백질인 보체가 과도하게 활성화되는 유전성 자가면역 질환. CD55가 적절히 조절되지 않을 경우, 보체는 건강한 세포를 공격하여 소화관을 따라 혈액과 림프관을 손상시키며 나아가 혈관 폐색 유발.
작용기전 : 야생형 및 변이형 보체 인자 C5에 높은 친화력으로 결합하여 이 인자의 활성을 차단하고 보체 경로를 매개로 하는 질병을 예방하도록 설계된 단일클론 항체.
약물유형: C5 보체 단백질을 표적으로 하는 monoclonal antibody
https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2023
2023년 5월~6월 사이에 미국 FDA에서 판매 허가를 받은 12종의 신약에 대한 정보(바로가기)
2023년 1월~4월 사이에 미국 FDA에서 판매 허가를 받은 14종의 신약에 대한 정보(바로가기)
약물유형(Modality)
저분자화합물의약품 4종, 단일클론항체신약(monoclonal antibody) 4종, 압타머(Aptamer) 1종.
- Nirsevimab-alip (Beyfortus), monoclonal antibody
- Vanflyta (quizartinib)
- Lotilaner (Xdemvy)
- Zuranolone (Zurzuvae)
- Avacincaptad pegol (Izervay), RNA aptamer
- Talquetamab-tgvs (Talvey), monoclonal antibody
- Elranatamab-bcmm (Elrexfio), monoclonal antibody
- Palovarotene (Sohonos)
- Pozelimab-bbfg (Veopoz), monoclonal antibody
1. 성분명(제품명) : Nirsevimab-alip (Beyfortus)
개발사 : 아스트라제네카(AstraZeneca)
적응증 : 소아용 호흡기 세포융합 바이러스(RSV: Respiratory Syncytial Virus) 예방 항체. 60세 이상 고령자용 RSV 백신은 이미 승인되어 있으며 이번에는 24개월 이하 영유아의 RSV 하기도질환 예방 항체가 FDA의 승인됨.
작용기전 : 베이포투스는 백신과는 다른 예방항체. 백신은 백신을 주입해 신체의 면역체계가 항체를 만들도록 유도하는 기전으로 작용하는 반면 예방항체는 체내에 합성항체(monoclonal antibody)를 주사로 주입하여 바이러스와 결합해 세포를 감염시키지 못하게 하는 기전으로 작용.
약물유형 : Monoclonal antibody with activity against RSV
2. 성분명(제품명) : Vanflyta (quizartinib)
개발사 : 다이이찌산쿄 (Daiichi Sankyo)
적응증 : (FLT3-ITD 변이를 가진) 급성 골수성 백혈병(AML: Acute Myeloid Leukemia) 1차 치료제. AML은 성인에서 가장 흔하게 발병하는 백혈병이며 새로 진단된 AML 환자 중 최대 37%는 FLT3 유전자 변이가 있고 이 중 약 80%가 FLT3-ITD 변이임. 2019년 일본에서 먼저 승인되어 사용중. 그러나 유럽 의약청 EMA에서는 승인 거절됨.
작용기전 : Receptor Tyrosine Kinase III에 속하는 사이토카인 수용체(cytokine receptor)인 FLT3 억제 (경구용). FLT3 유전자는 혈액 내 세포 생산 과정을 조절하는 역할을 하는데, FLT3 변이는 혈액암 성장을 촉진해 재발 위험과 생존 기간을 줄인다. FLT3 변이 진단 검사도 함께 승인됨.
약물구조

3. 성분명(제품명) : Lotilaner (Xdemvy)
개발사 : 미국 타서스 파마슈티컬스 (Tarsus Pharmaceuticals)
적응증 : 안구건조증을 유발하는 대표적인 원인 질환인 모낭충 진드기(Demodex mite)에 의한 안검염(눈꺼풀 및 눈꺼풀 테두리에 발생하는 염증) 치료 안약(점안액)
작용기전 : GABA-Cl channel을 차단해 모낭충 진드기 등 외부 기생충을 마비, 박멸시킴. 반려견의 진드기 치료제로도 사용되고 있는 약제를 사람의 안구에 투약 가능하도록 희석시킨 안약 (점안액)
약물구조

4. 성분명(제품명) : Zuranolone (Zurzuvae)
개발사 : 세이지 (Sage Therapeutics) & 바이오젠 (Biogen)
적응증 : 첫 경구용 산후우울증 치료제. 2주간 1일 1회 복용으로 우울 증상 빠르게 호전. 함께 신청된 주요우울장애(MDD: Major depressive disorder) 적응증은 허가 거절
작용기전 : 뇌 신경전달물질인 GABA-A 수용체 조절 (positive allosteric modulator of the GABA-A receptor)
약물구조

5. 성분명(제품명) : Avacincaptad pegol (Izervay)
개발사 : 아이베릭 바이오 (Iveric Bio). 아스텔라스 (Astellas Pharma)에 인수됨.
적응증 : 지도형 위축(Geographic Atropy: GA)을 동반한 노인성 황반변성(AMD) 치료제. 노인성 황반변성(AMD)은 망막의 중심부에 있는 시신경 조직인 황반에 노폐물(드루젠)이 쌓이거나 비정상적인 신생 혈관이 자라면서 황반이 손상돼 시야의 중심부를 보는 시력인 중심시(central vision)를 잃는 질환. 망막의 지도 모양 위축은 황반의 중심부가 손상되면서 망막세포가 사멸하는 현상으로 AMD 말기에 나타난다.
작용기전 : 면역시스템의 작용을 도와주는 C5보체(complement system) 단백질 저해제로 3상 임상시험에서 투여 12개월 후 지도 모양 위축의 진행을 35% 억제하는 효과를 나타냄. 안구내 주사제 (Intravitreal injection, IVT).
약물구조 : 39개 변형 nucleoside로 구성된 RNA 압타머(aptamer). RNA aptamer covalently bound to a branched polyethylene glycol (PEG) molecule.
6. 성분명(제품명) : Talquetamab-tgvs (Talvey)
개발사 : 존슨앤드존슨 (Janssen Pharmaceutical Companies of Johnson & Johnson)
적응증 : 재발성 또는 불응성 다발성 골수종 5차 치료제. 다발성 골수종은 골수에서 면역 항체를 만드는 형질 세포에서 발생하는 혈액암이다. 이번 허가는 가속 승인(Accelerated Approval) 제도를 통해 부여된 조건부 허가다. 따라서 얀센은 향후 임상 3상 시험에서 탈베이(Talvey)의 유효성 및 안전성을 확증해야 이 신약을 정식 허가로 전환할 수 있다.
작용기전 : T-세포 표면의 CD3 수용체와 골수종세포(multiple myeloma cell) 표면의 GPRC5D 수용체를 표적으로 하는 이중특이성(bispecific) 항체, T-cell engager.
약물유형 : CD3와 GPRC5D 표적으로 하는 이중특이성 항체 신약 (bispecific antibody).
7. 성분명(제품명) : Elranatamab-bcmm (Elrexfio)
개발사 : 화이자(Pfizer)
적응증 : (프로테아좀 억제제, 면역조절제제, 항-CD38 단클론항체를 포함해 적어도 4가지 치료를 받은) 재발 또는 불응성 다발골수종(multiple myeloma) 성인 환자의 치료제로 가속 승인(Accelerated Approval). 피하주사제(SC)형으로 주 1회 24주 치료
작용기전 : 골수종 세포의 B세포 성숙항원(BCMA)과 T세포의 CD3에 결합해 T세포를 활성화함에 따라 골수종세포의 사멸을 유도하는 작용을 하는 이중특이항체.
약물유형 : BCMA와 CD3 표적 이중특이항체
8. 성분명(제품명) : Palovarotene (Sohonos)
개발사 : 프랑스 제약사 입센(Ipsen)
적응증 : 진행성 골화성 섬유이형성증(FOP: Fibrodysplasia ossificans progressiva) 치료제. FOP는 결합조직에서 뼈가 계속 자라는 초희귀 유전성 골질환. EU 승인은 실패.
작용기전 : 경구용 선택적 레티노산 수용체 감마(Retinoic Acid Receptor Gamma, RARγ) 촉진제 (agonist).
약물구조

9. 성분명(제품명) : Pozelimab-bbfg (Veopoz)
개발사 : 리제네론 파마슈티컬스(Regeneron Pharmaceuticals)
적응증 : 초희귀 유전성 면역질환인 CD55-결핍 단백질 손실성 장질환인 채플병(CHAPLE diease: 전세계 환자수는 약 100명인 초희귀 질환) 치료제. 채플병은 CD55 유전자에 변이가 발생하여 면역계에 작용하는 혈청 안의 단백질인 보체가 과도하게 활성화되는 유전성 자가면역 질환. CD55가 적절히 조절되지 않을 경우, 보체는 건강한 세포를 공격하여 소화관을 따라 혈액과 림프관을 손상시키며 나아가 혈관 폐색 유발.
작용기전 : 야생형 및 변이형 보체 인자 C5에 높은 친화력으로 결합하여 이 인자의 활성을 차단하고 보체 경로를 매개로 하는 질병을 예방하도록 설계된 단일클론 항체.
약물유형: C5 보체 단백질을 표적으로 하는 monoclonal antibody
작성: 이현규 (한국화학연구원)
참고자료(바로가기)https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2023