연구동향
모든 종류의 KRAS 변이 단백질을 저해할 수 있는 “Pan-KRAS” 화합물 발굴 (Nature, 2023)
Author
관리자
Date
2023-06-21 17:10
Views
4487
KRAS는 여러 암종에서 발견되는 주요 종양 유전자 중 하나로 비소세포폐암(NSCLC: Non-Small Cell Lung Cancer)에서는 전체 유전자 변이의 약 25%를 차지한다.
KRAS 단백질은 종양 세포의 성장 신호를 GDP(비활성)/GTP(활성)와의 가역적 결합을 통하여 세포 외부에서 핵 안으로 보내는 스위치 역할을 하므로 KRAS의 변이가 생긴 단백질 부위를 찾아 신호를 차단하면 암세포 증식을 막을 수 있는 치료제의 개발이 가능할 것이다.
KRAS 변이의 중요성에도 불구하고 KRAS가 구조상 GDP/GTP 결합부위가 아닌 allosteric inhibitor가 결합할 만한 포켓이 없는 평이한 구조를 가졌기 때문에 오랫동안 undruggable target으로 여겨져 저분자 화합물 억제제 개발은 쉽게 이루어지지 않았다.
그러나 2013년 KRAS-G12C 변이 단백질(12번째 codon에서 G(glycine)가 C(cystein)으로 치환)의 구조연구에서 KRAS의 beta-sheet의 아랫부분에 저분자 화합물이 결합할 만한 allosteric pocket 발견되었고 이 allosteric pocket은 KRAS가 GDP와 결합상태일 때만 노출되는 특징을 가졌는데 pocket에 위치한 cystein과 공유 결합을 할 수 있는 저분자 화합물을 투여하면 KRAS-GDP 구조를 안정화시켜 KRAS를 불활성 상태로 유지하게 함으로써 KRAS-G12C 변이 단백질의 활성을 억제할 수 있다는 메커니즘이 처음으로 제시하였다.
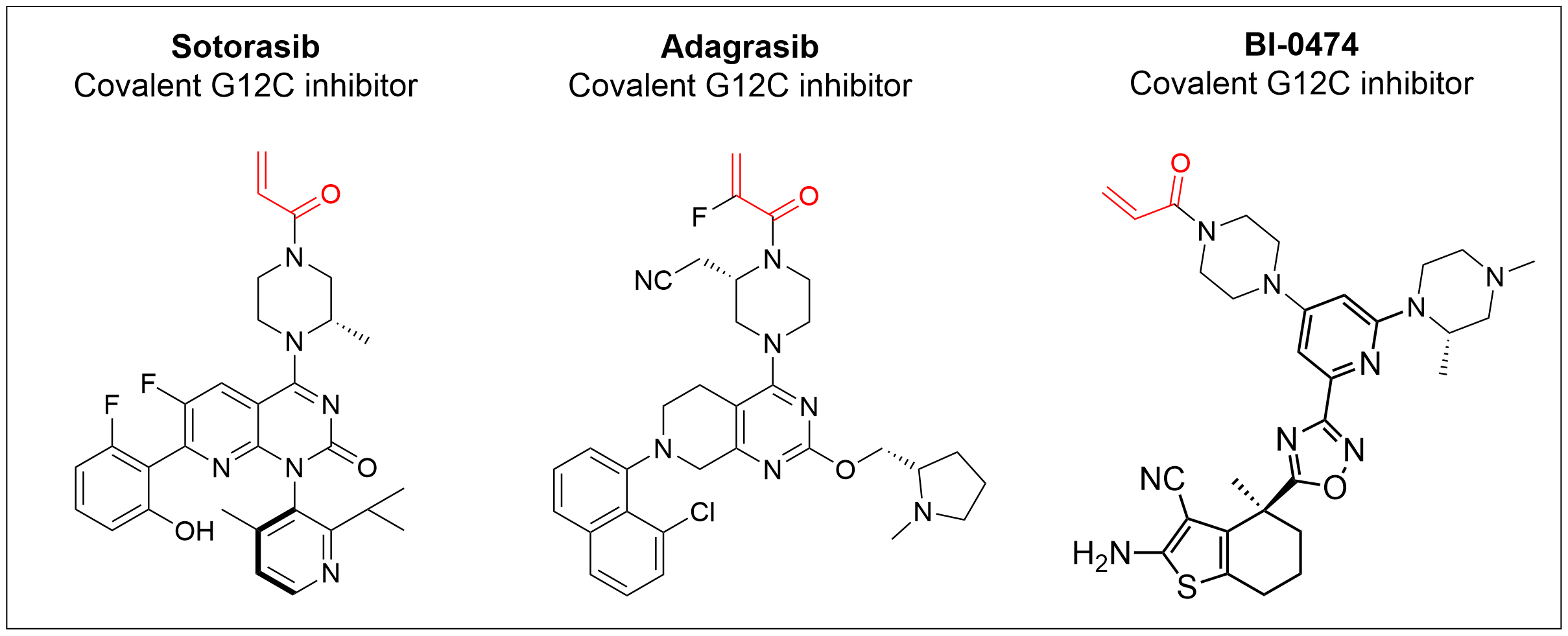
이에 따라 KRAS-G12C 변이 단백질 저해 약물의 개발이 가속화되었고 2021년 처음으로 암젠이 개발한 루마크라스(Lumakras, Sotorasib, 바로가기)와 이어서 2022년에는 미라티테라퓨틱의 크라자티(Krazati, Adagrasib, 바로가기)가 비소세포폐암의 표적치료제로 FDA의 허가를 받았다. 이들 약제는 공통적으로 KRAS-G12C 변이 단백질의 allosteric pocket에 위치한 cystein과 공유 결합을 할 수 있는 Michael acceptor 구조를 가지고 있다. 그러나 이들 약제는 KRAS-G12C 변이 종양에는 우수한 항암효과를 나타내었지만 allosteric pocket이 없거나 cystein 잔기를 가지지 않는 wild-type KRAS 또는 G12C 이외의 KRAS 변이 단백질에 의한 종양에는 뚜렷한 효과를 보이지 않았다.
KRAS-G12C 변이 단백질에 의한 종양을 제외한 wild-type KRAS 또는 G12C 이외의 non-G12C KRAS 변이 단백질에 의한 종양발생이 다수를 차지하고 있지만 이들 종양에 대한 치료제는 아직까지 개발되어 있지 않은 실정이다.
이러한 문제를 해결하기 위한 노력의 일환으로, 미모리얼 슬로안 캐터링 암센터 (Memorial Sloan Kettering Cancer Center) 및 베링거 인겔하임 (Boehringer Ingelheim) 연구자들이 Wild-type KRAS 및 G12C KRAS 뿐만 아니라 대부분의 non-G12C KRAS 변이 단백질도 저해할 수 있는 “Pan-KRAS” 저해 저분자 화합물을 개발하여 2023년 5월 31일자 Nature지에 보고 하였다. (Nature 2023, 바로가기)
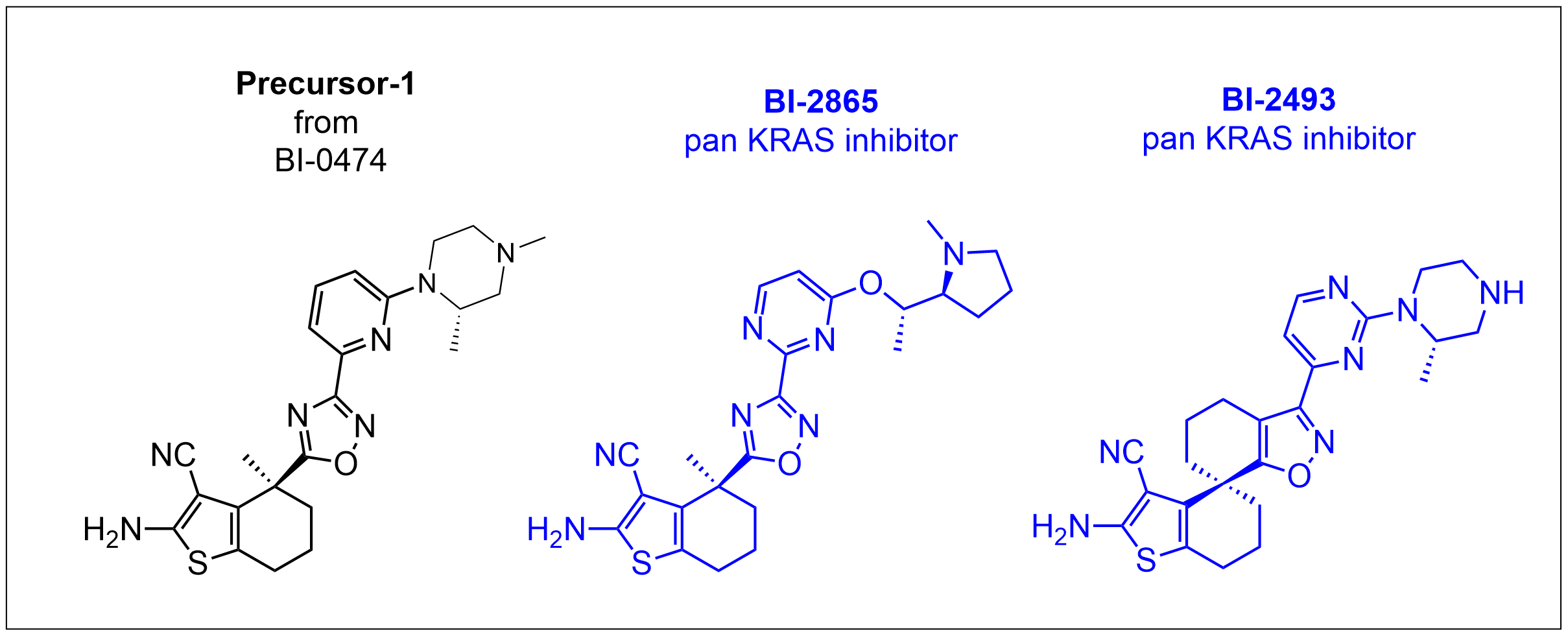
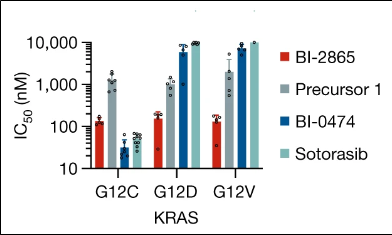
연구팀은 베링거 인겔하임에서 개발중인 KRAS-G12C 선택적 저해제인 BI-0474 화합물(바로가기)에서 cystein과 공유결합을 할 수 있는 핵심구조인 Michael acceptor 부분(acrylate 부분구조)을 제거한 Precursor-1 화합물은 예상대로 KRAS-G12C 변이종에 대한 활성이 급격하게 감소한다는 사실을 확인했으나 대부분의 non-G12C 변이 KRAS에 대해서는 상당한 활성을 보인다는 사실을 발견하였다. 연구자들은 KRAS 단백질과 KRAS 저해화합물의 결합결정구조 연구와 추가적인 structure-based design 및 최적화 연구를 통하여 Wild-type KRAS 및 대부분의 non-G12C KRAS 변이 단백질을 저해할 수 있는 “Pan-KRAS” 저해 저분자 화합물인 BI-2865와 BI-2493을 발굴하였다. 이들 화합물은 KRAS와 구조적으로 유사한 HRAS 및 NRAS의 활성은 저해하지 않았다. 다만 이들 화합물은 아직 인체실험은 진행되지 않았고 KRAS 변이를 가진 동물(mice)실험에서 종양의 성장이 억제된다는 것을 확인하였다. 상세한 내용은 아래 원논문 참조.
BI-2865와 BI-2493 화합물은 여러 화합물 vendor에서 구매가능하며 베링거 인겔하임에서 개설한 chemical probe 공유포털인 OpnMe (http://opnme.com) 에서 공동연구를 전제로 얻을 수 있다.
참고논문 (바로가기)
Nature, 2023. “Pan-KRAS inhibitor disables oncogenic signalling and tumour growth”
KRAS 단백질은 종양 세포의 성장 신호를 GDP(비활성)/GTP(활성)와의 가역적 결합을 통하여 세포 외부에서 핵 안으로 보내는 스위치 역할을 하므로 KRAS의 변이가 생긴 단백질 부위를 찾아 신호를 차단하면 암세포 증식을 막을 수 있는 치료제의 개발이 가능할 것이다.
KRAS 변이의 중요성에도 불구하고 KRAS가 구조상 GDP/GTP 결합부위가 아닌 allosteric inhibitor가 결합할 만한 포켓이 없는 평이한 구조를 가졌기 때문에 오랫동안 undruggable target으로 여겨져 저분자 화합물 억제제 개발은 쉽게 이루어지지 않았다.
그러나 2013년 KRAS-G12C 변이 단백질(12번째 codon에서 G(glycine)가 C(cystein)으로 치환)의 구조연구에서 KRAS의 beta-sheet의 아랫부분에 저분자 화합물이 결합할 만한 allosteric pocket 발견되었고 이 allosteric pocket은 KRAS가 GDP와 결합상태일 때만 노출되는 특징을 가졌는데 pocket에 위치한 cystein과 공유 결합을 할 수 있는 저분자 화합물을 투여하면 KRAS-GDP 구조를 안정화시켜 KRAS를 불활성 상태로 유지하게 함으로써 KRAS-G12C 변이 단백질의 활성을 억제할 수 있다는 메커니즘이 처음으로 제시하였다.
이에 따라 KRAS-G12C 변이 단백질 저해 약물의 개발이 가속화되었고 2021년 처음으로 암젠이 개발한 루마크라스(Lumakras, Sotorasib, 바로가기)와 이어서 2022년에는 미라티테라퓨틱의 크라자티(Krazati, Adagrasib, 바로가기)가 비소세포폐암의 표적치료제로 FDA의 허가를 받았다. 이들 약제는 공통적으로 KRAS-G12C 변이 단백질의 allosteric pocket에 위치한 cystein과 공유 결합을 할 수 있는 Michael acceptor 구조를 가지고 있다. 그러나 이들 약제는 KRAS-G12C 변이 종양에는 우수한 항암효과를 나타내었지만 allosteric pocket이 없거나 cystein 잔기를 가지지 않는 wild-type KRAS 또는 G12C 이외의 KRAS 변이 단백질에 의한 종양에는 뚜렷한 효과를 보이지 않았다.
KRAS-G12C 변이 단백질에 의한 종양을 제외한 wild-type KRAS 또는 G12C 이외의 non-G12C KRAS 변이 단백질에 의한 종양발생이 다수를 차지하고 있지만 이들 종양에 대한 치료제는 아직까지 개발되어 있지 않은 실정이다.
이러한 문제를 해결하기 위한 노력의 일환으로, 미모리얼 슬로안 캐터링 암센터 (Memorial Sloan Kettering Cancer Center) 및 베링거 인겔하임 (Boehringer Ingelheim) 연구자들이 Wild-type KRAS 및 G12C KRAS 뿐만 아니라 대부분의 non-G12C KRAS 변이 단백질도 저해할 수 있는 “Pan-KRAS” 저해 저분자 화합물을 개발하여 2023년 5월 31일자 Nature지에 보고 하였다. (Nature 2023, 바로가기)
<Covalent KRAS-G12C mutant inhibitors>

<Non-covalent Pan-KRAS inhibitors>

<Proliferation inhibition activity of compounds against cancer-causing KRAS mutants (G12C, G12D, G12V)>

연구팀은 베링거 인겔하임에서 개발중인 KRAS-G12C 선택적 저해제인 BI-0474 화합물(바로가기)에서 cystein과 공유결합을 할 수 있는 핵심구조인 Michael acceptor 부분(acrylate 부분구조)을 제거한 Precursor-1 화합물은 예상대로 KRAS-G12C 변이종에 대한 활성이 급격하게 감소한다는 사실을 확인했으나 대부분의 non-G12C 변이 KRAS에 대해서는 상당한 활성을 보인다는 사실을 발견하였다. 연구자들은 KRAS 단백질과 KRAS 저해화합물의 결합결정구조 연구와 추가적인 structure-based design 및 최적화 연구를 통하여 Wild-type KRAS 및 대부분의 non-G12C KRAS 변이 단백질을 저해할 수 있는 “Pan-KRAS” 저해 저분자 화합물인 BI-2865와 BI-2493을 발굴하였다. 이들 화합물은 KRAS와 구조적으로 유사한 HRAS 및 NRAS의 활성은 저해하지 않았다. 다만 이들 화합물은 아직 인체실험은 진행되지 않았고 KRAS 변이를 가진 동물(mice)실험에서 종양의 성장이 억제된다는 것을 확인하였다. 상세한 내용은 아래 원논문 참조.
BI-2865와 BI-2493 화합물은 여러 화합물 vendor에서 구매가능하며 베링거 인겔하임에서 개설한 chemical probe 공유포털인 OpnMe (http://opnme.com) 에서 공동연구를 전제로 얻을 수 있다.
참고논문 (바로가기)
Nature, 2023. “Pan-KRAS inhibitor disables oncogenic signalling and tumour growth”
작성: 이현규 (한국화합물은행)