연구동향
“2025년 가장 기대되는 신약 Top 10” (Evaluate Pharm 선정)
선정된 10개 신약을 약물 유형별로 보면,
저분자 화합물신약 6종 (GLP-1 효능제 포함), 항체 등 바이오신약 2종, ADC 1종, 백신 1종으로 구성되어 있다.
아래에 각 약물들에 대하여 개발사, 적응증, 작용기전, 약물유형, 화학구조에 대하여 요약 정리하였다.
1. Vanza triple (상품명: 알리프트렉 (Alyftrek))
- 개발사: 버텍스 (Vertex Pharmaceuticals, 미국)
- 적응증: 낭포성 섬유증 (Cystic Fibrosis) 치료제. 낭포성 섬유증은 유전자 결함에 의한 질환으로 기관지의 점액 분비선에서 비정상적으로 진하고 끈적끈적한 점액이 만들어지며 이로 인하여 기도 폐쇄와 심각한 만성 폐질환 및 췌장관련 증상이 동반되는 희귀질환이다.
- 작용기전: 낭포성 섬유증의 발병기전은 땀샘이나 기도에 주로 분포하는 염소이온채널인 낭포성 섬유증 유발 세포막단백질 (CFTR: cystic fibrosis transmembrane conductance regulator)의 이상으로 염소이온과 나트륨이온의 이온밸런스가 붕괴되어 수분이 배출되지 않아 매우 뻑뻑한 점액이 생성되게 된다.
Vanza triple은 CFTR 단백질 조절제(modulator)로 3종의 약제가 각각 CFTR 단백질의 다른 위치에 결합하여 협동적으로 CFTR 단백질을 정상적으로 작동하도록 돕는 역할을 한다.
버텍스는 낭포성 섬유증에 강점을 가진 제약사로 이미 낭포성 섬유증에 대해 4개의 FDA 승인 신약을 가지고 있으며 5번째 낭포성 섬유증 치료제로 3종의 약제를 혼합한 약제인 Alyftrek (vanza triple: vanzacaftor + tezacaftor + deutivacaftor)을 1일 1회 복용하는 경구용 약제로 2024년 12월 20일 FDA의 승인을 받았다. (바로가기)
기존 버텍스의 3종 혼합제인 트리카프타(Trikafta, 1일 2회 복용)의 뒤를 이을 새로운 낭포성 섬유증 치료제로 주목받고 있다.
버텍스는 Alyftrek의 1년간 약값으로 $370,269 (약 5억원)을 책정하였다.
- 2030년 예상 매출액: 83억 달러
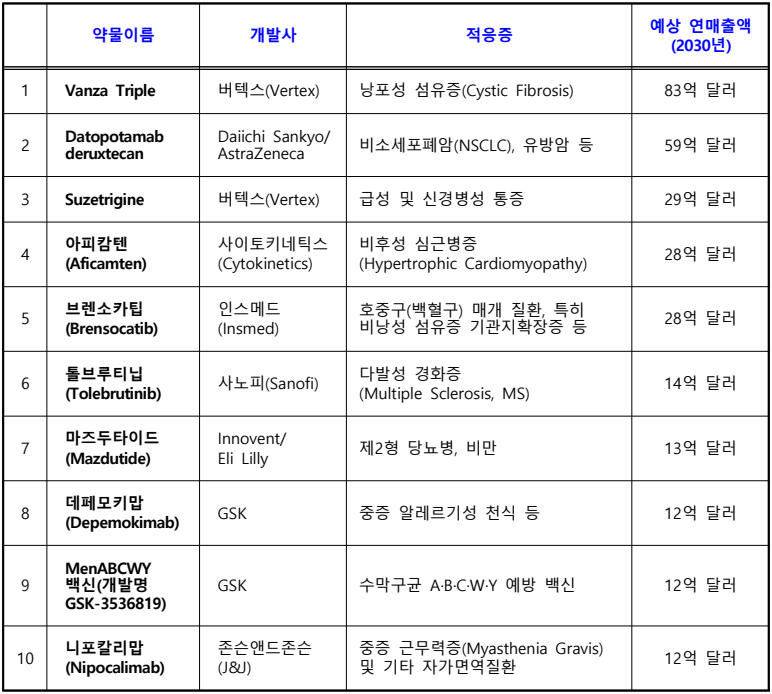
- 알리프트렉 (Alyftrek) 의 화합물 구조
(위에서부터 차례대로 vanzacaftor, tezacaftor, deutivacaftor)
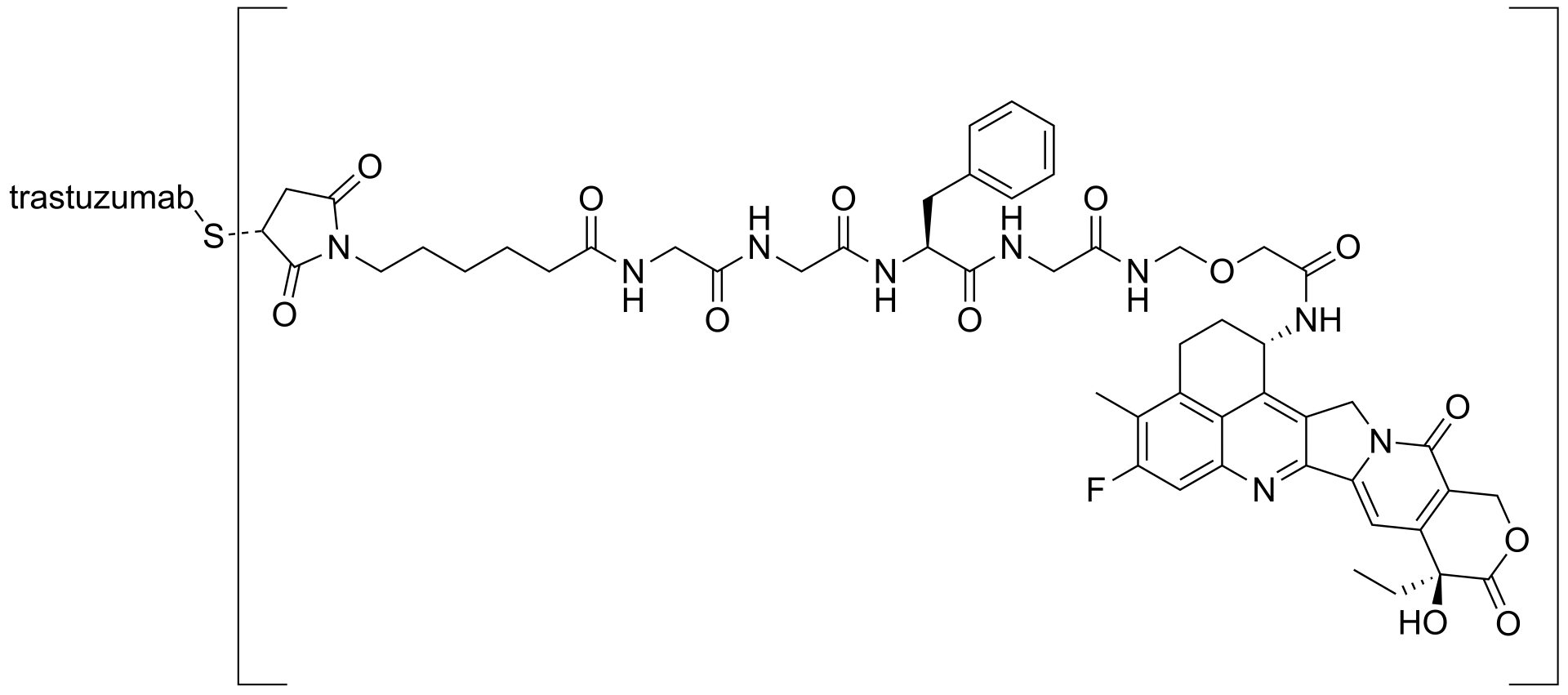
2. Datopotamab-Deruxtecan (Dato-DXd, 상품명: 다트로웨이(Datroway))
- 개발사: 일본 Daiichi Sankyo & 영국 AstraZeneca
- 적응증: 폐암, 유방암 치료 (Lung and breast cancers)
- 작용기전 및 약물유형: Dato-DXt는 TROP2 단백질을 표적으로 하는 항체-약물 접합체(ADC: antibody-drug conjugate)이다. TROP2 단백질은 비소세포폐암(NSCLC), 유방암, 자궁경부암과 같은 여러 암세포 표면에 과발현되어 있다. Dato-DXt는 TROP2 IgG1 단일클론 항체에, 엑세테칸(exatecan: topoisomerase I inhibitor) 유도체인 DXd 페이로드를 tetrapeptide 기반의 cleavable linker를 통해 연결한 ADC로, 현재 유방암, 폐암과 같은 TROP2를 발현하는 암종을 대상으로 한 10여개의 임상시험이 진행되고 있다.
유방암분야 개발현황: HR 양성/HER2 음성 전이성 유방암 (unresectable or metastatic HR-positive, HER2-negative breast cancer) 치료제로 올해(2025년) 1월 17일 미국 FDA의 허가를 획득했다. 상품명: 다트로웨이(Datroway)
폐암분야 개발현황: Dato-DXt는 비소세포폐암(NSCLC) 치료 임상 과정에서 환자 사망 사례 등의 문제가 발생하자 비소세포폐암(NSCLC) 2차 치료제로는 승인신청을 철회했다. 대신 EGFR 변이를 가진 비소세포폐암(NSCLC) 환자 집단만을 위한 2차 치료제 승인을 재신청했고, FDA는 우선심사(priority review) 규정에 따라 2025년 7월 12일 이전에 결정을 내릴 예정이다.
Dato-DXt는 엔허투(Enhertu)를 잇는 차세대 항암치료제가 될 것이라는 평가를 받고 있다.
- 2030년 예상 매출액: 59억 달러
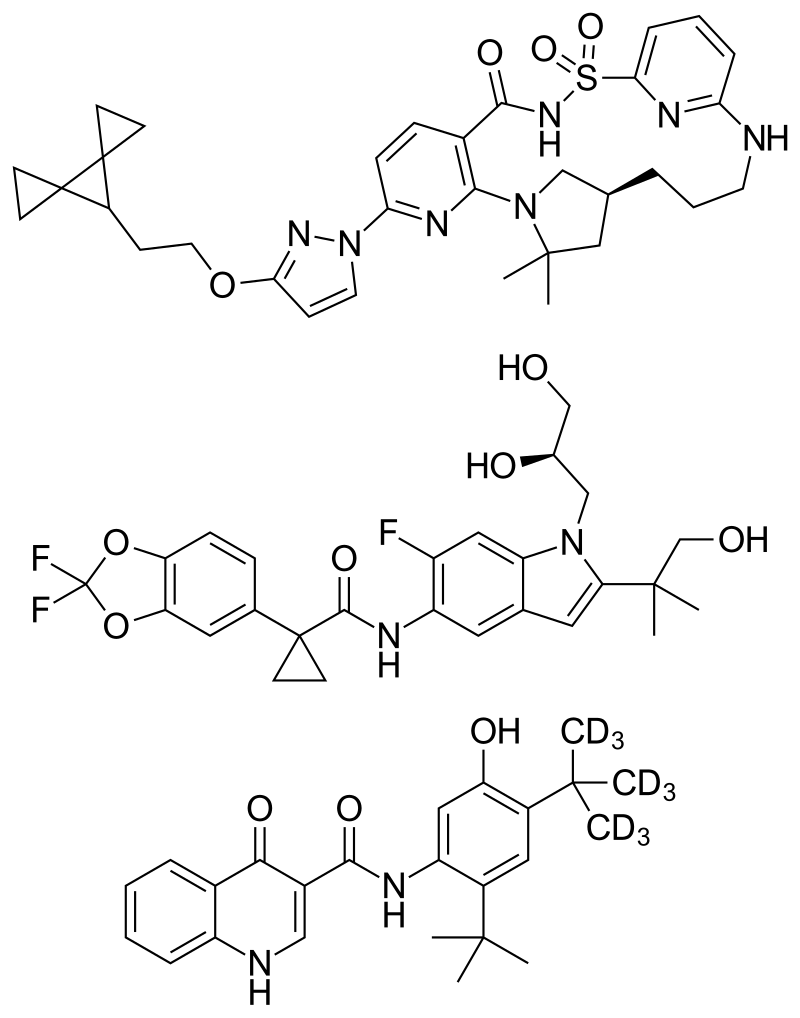
- Dato-DXd 화학구조:
3. Suzetrigine (상품명: Journavx, 저너백스)
- 개발사: 버텍스 (Vertex Pharmaceuticals, 미국)
- 적응증: 급성 통증 치료제. 중독성 등의 부작용이 있는 기존의 마약성 진통제를 대체할 수 있는 최초의 “비마약성(non-opioid)” 진통제로 수술, 사고, 부상 등에 의해 발생하는 대부분의 중등도 및 중증의 급성 통증의 치료제로 승인받음. (adults with moderate-to-severe acute pain)
- 작용기전: 저너백스(Journavx)는 말초 신경계의 통증 신호전달에 중요한 역할을 하는 나트륨이온채널(NaV1.8)을 선택적으로 억제해 통증이 퍼지는 것을 막는 기전을 가진 약물로 뇌의 중추신경계에 직접 작용하여 중독성을 유발하는 마약성(opioid) 진통제와는 달리 말초신경에서만 작용하여 통증 신호가 뇌로 전달되는 것을 원천적으로 차단하는 작용기전을 가지므로 중독성 문제가 없다.
저너백스(Journavx)는 20년 만에 허가 받은 새로운 유형의 진통제 (first new class of pain medicine)로 FDA의 혁신 치료제(Breakthrough Therapy), 패스트 트랙(Fast Track) 및 신속심사(Priority Review) 대상으로 지정을 거쳐 이번에 1일 2회 복용하는 경구용 급성 통증 치료제로 허가를 받았다.
또한, 저너백스(Journavx)는 당뇨병성 말초신경병증(DPN: Diabetic Peripheral Neuropathy) 환자를 대상으로 진행한 임상2상에서도 시판 신경병증 진통제 경쟁약물인 Pfizer의 라리카(Lyrica, 성분명: pregabalin) 대비 더 높은 통증 저감효과를 보였고 현재 임상 3상을 진행중이다.
- 2030년 예상 매출액: 29억 달러
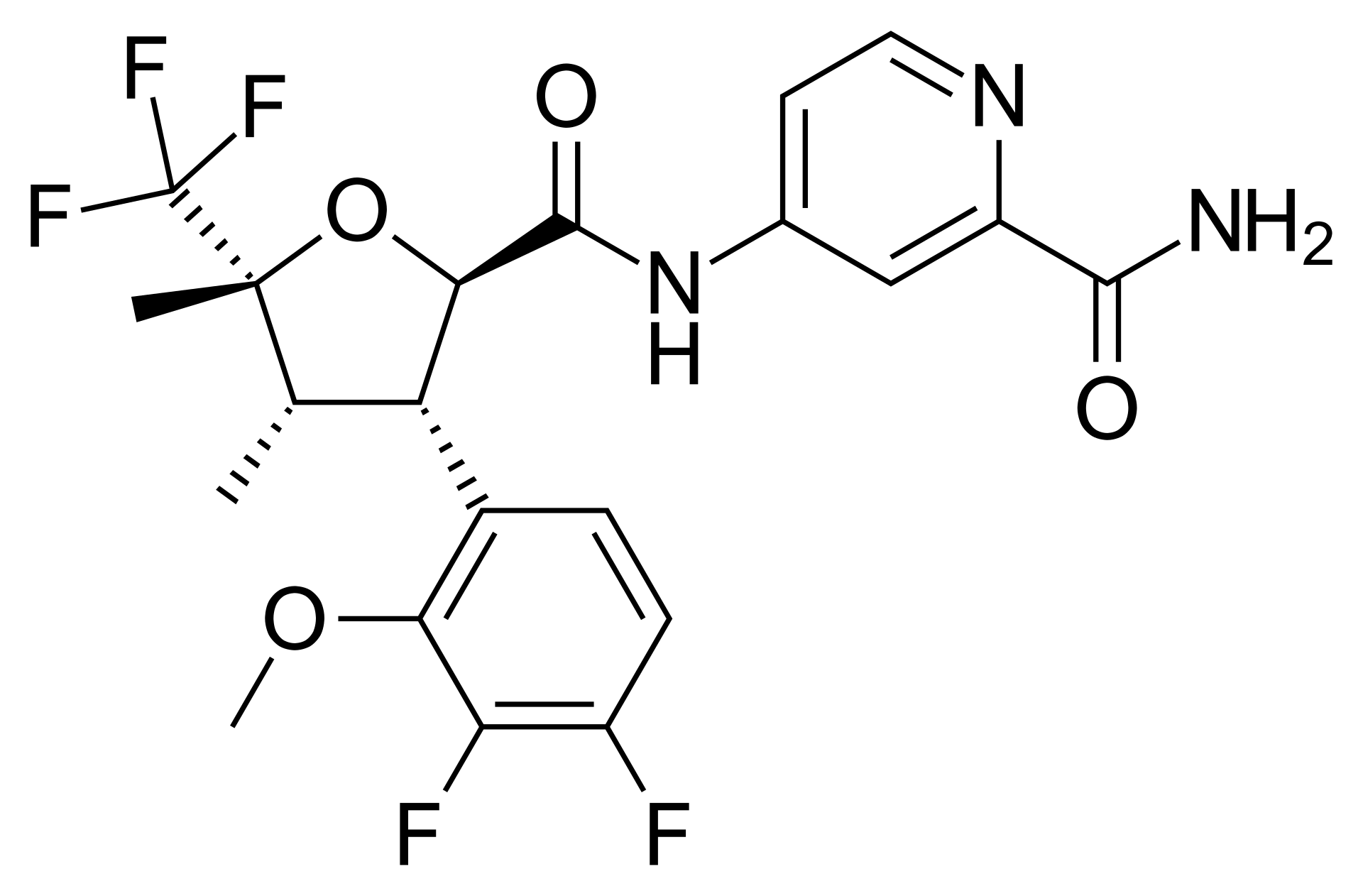
- 저너백스(Journavx)의 화합물 구조:
4. 아피캄텐 (Aficamten)
- 개발사: 사이토키네틱스 (Cytokinetics, 미국)
- 적응증: 비대성 심근병증 (HCM: Hypertrophic Cardiomyopathy) 치료를 위하여 개발중인 경구용 약물. 비대성 심근병증은 대동맥판 협착증이나 고혈압과 같은 다른 증세 없이 비정상적으로 좌심실벽이 두꺼워져 심장박출 기능이 제한되는 질환으로 현재 사용되는 비대성 심근병증 치료제로는 지난해 2022년 4월 승인을 받은 BMS의 캄지오스(Camzyos, 성분명: Mavacamten)가 있다.
- 작용기전: 아피캄텐(aficamten)은 캄지오스(Camzyos)와 유사하게 심장 내에서 마이오신(myosin, 심장 근육 세포의 수축을 유도하는 단백질)을 저해하는 작용기전을 가진다. 마이오신 단백질과 근육을 구성하는 단백질인 액틴의 과도한 교차결합 형성을 억제해 심근의 수축 및 좌심실 비대증을 감소시키는 작용을 한다.
2023년 12월에 발표된 아피캄텐(aficamten)의 임상 3상(SEQUOIA-HCM 시험)에서 위약대비 1차, 2차 종결점을 충족하고 운동능력을 유의미하게 개선한 고무적이고 긍정적인 주요결과들을 공개했다. 1차 종결점인 치료 24주차 심폐운동능력검사(CPET)로 측정한 최대산소섭취량(pVO2)은 아피캄텐군이 위약 대비 1.74mL/kg/min 차이를 보이며 임상적, 통계적으로 유의미하게 운동 능력을 개선했다. 아울러 주요 2차 종결점으로 설정한 치료 12주 및 24주차 삶의질 지표(KCCQ-CSS), 심근병증 설문지 점수, 심부전 심각도지표(NYHA), 좌심실 유출관(LVOT-G) 구배 변화 등 10가지 모두를 유의미하게 개선하였다.
아피캄텐이 시장에 출시되면 BMS의 캄지오스와 해당 질환 영역에서 경쟁이 펼쳐질 것으로 예상되고 있다.
- 2030년 예상 매출액: 28억 달러
- 아피캄텐(aficamten)의 화합물구조
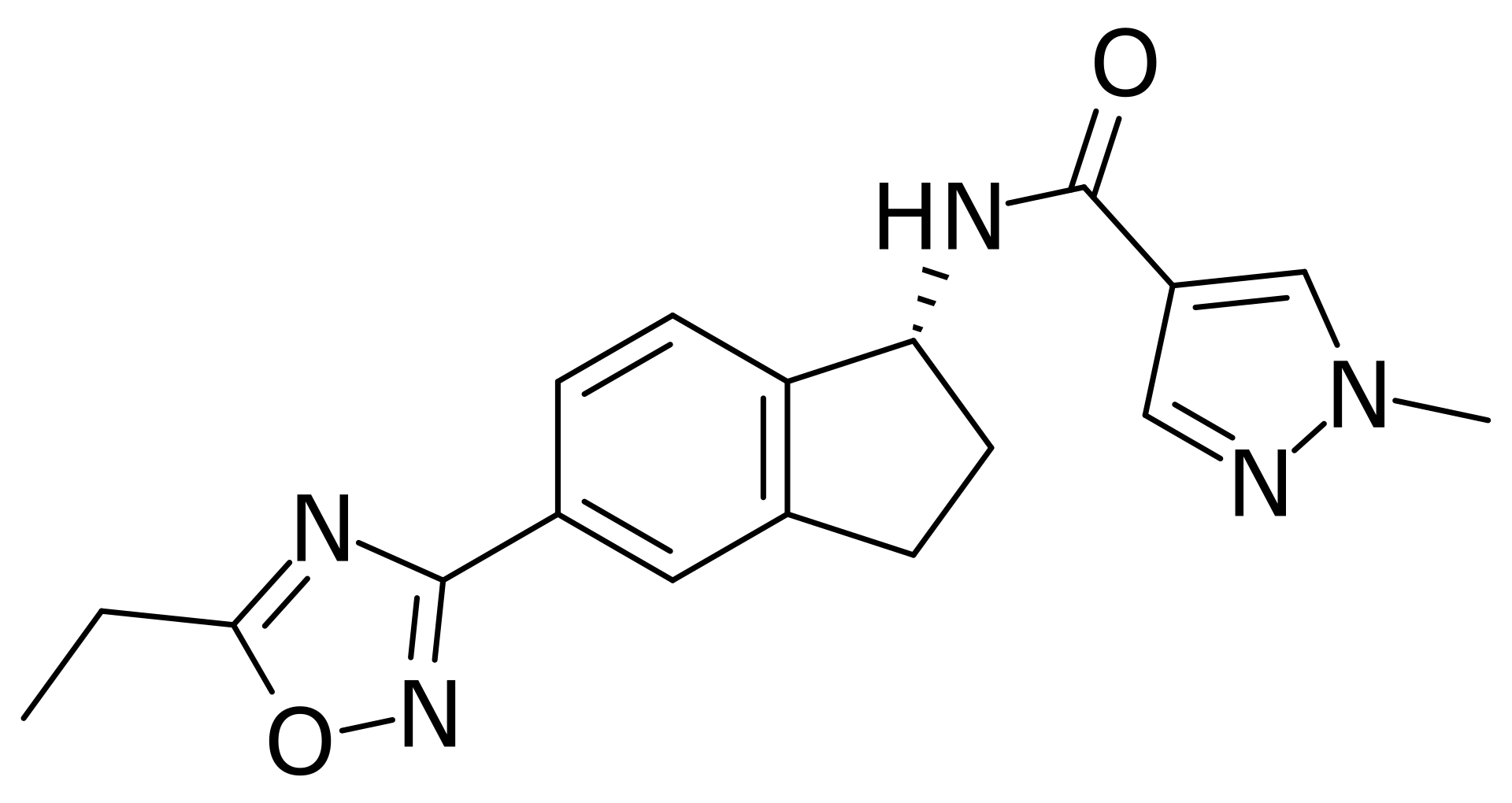
5. 브렌소카팁 (Brensocatib)
- 개발사: 인스메드 (Insmed)
- 적응증: 호중구 매개 질환 (Neutrophil-mediated diseases), 특히 비-낭포성 섬유증 폐기관 확장증 치료제 (non-cystic fibrosis bronchiectasis: 기관지가 영구적으로 확장되어 탄력을 잃은 상태로, 만성 폐질환의 일종)로 현재 FDA 심사중.
- 작용기전: 브렌소카팁은 백혈구중에서 호중구(Neutrophil)를 활성화하는 DPP1(dipeptidyl peptidase 1) 효소를 억제하는 작용기작을 가지고 있다.
호중구가 과활성화되면 지나치게 염증 반응을 일으키고 조직을 손상시키게 된다. 브렌소카팁은 폐기관 확장증 치료를 위한 새로운 치료법으로 개발되고 있다.
브렌소카팁은 이 외에도 당뇨(diabetes), 루푸스(lupus: 결핵성 피부염), 다발성 경화증(multiple sclerosis), 관절염(rheumatoid arthritis) 등 여러 가지 호중구 매개 질환 치료제로도 개발을 시도 중이다.
- 2030년 예상 매출액: 28억 달러
- 브렌소카팁(Brensocatib) 화합물 구조:
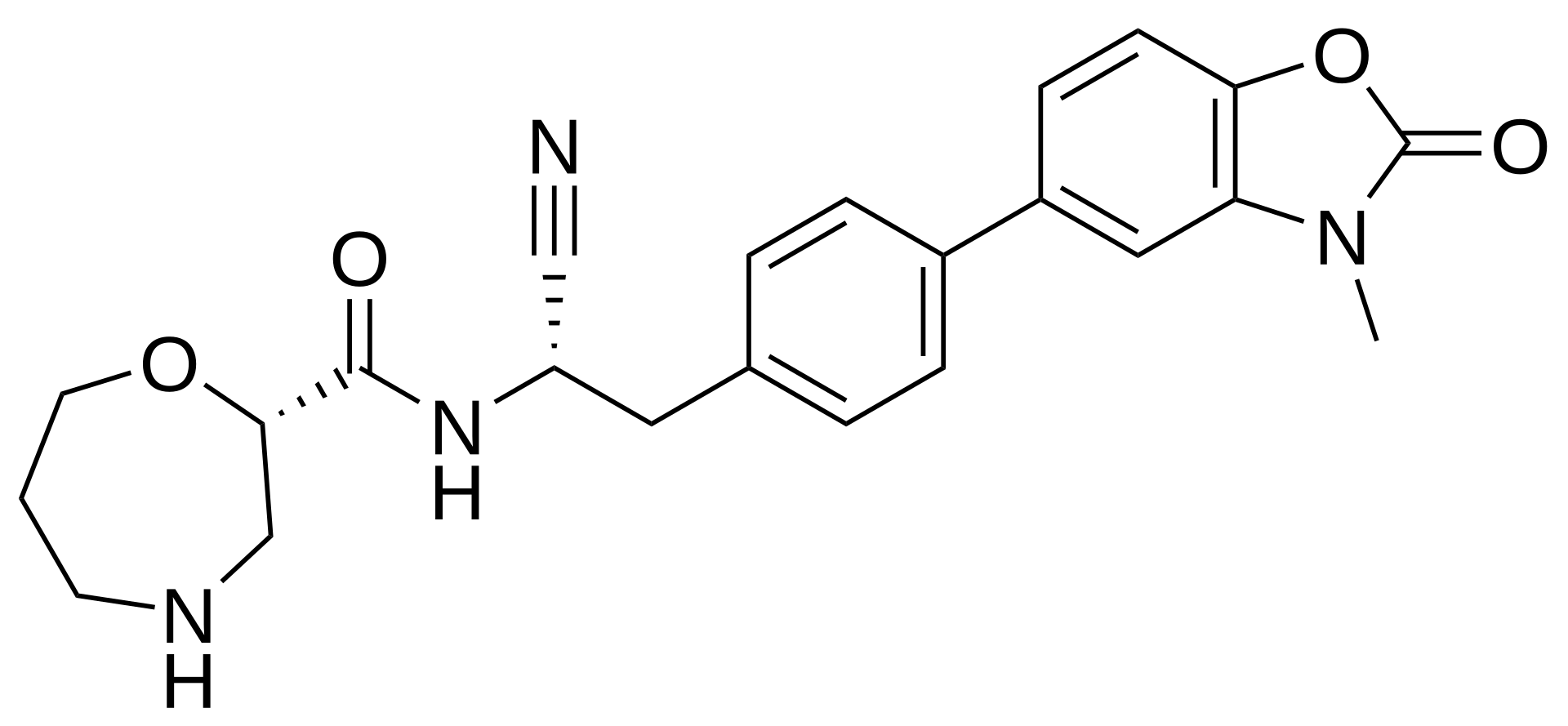
6. 토레브루티닙 (Tolebrutinib)
- 개발사: 사노피 (Sanofi)
- 적응증: 다발성 경화증 (MS: Multiple Sclerosis)
- 작용기전: BTK-저해제 (covalent BTK inhibitor). 2020년 사노피가 프린시피아(Principia Biopharma)로부터 37억 달러에 인수함. 2023년 다발성 경화증(MS: Multiple Sclerosis)과 중증 근무력증(myasthenia gravis)에 대한 임상을 시작했으나 중증 근무력증 부분은 간독성 가능성 때문에 중단하고 다발성 경화증 분야에만 임상을 진행하기로 결정. 2024년 12월에 비재발성 2차 진행성 다발성 경화증(nrSPMS: non-relapsing secondary progressive multiple sclerosis)에 대하여 FDA로부터 혁신치료제 (breakthrough therapy designation) 지정을 받았다.
- 2030년 예상 매출액: 14억 달러
- 토레브루티닙 (Tolebrutinib) 화합물 구조:
7. 마즈두타이드 (Mazdutide)
- 개발사: 이노벤트(Innovent) & 일라이 릴리(Eli Lilly)
- 적응증: 제2형 당뇨병, 비만
- 작용기전: GLP-1R agonist인 위고비(Wegovy, 세마글루타이드: Semaglutide, Novo Nordisk), GLP-1R/GIP 이중 작용제인 젭바운드(Zepbound, Tirzepatide: 티르제파타이드, Eli Lilly)에 이어 Eli Lilly의 히든카드인 GLP-1R/Glucagon 이중 작용제인 마즈두타이드(Mazdutide)가 새롭게 개발되고 있다.
Eli Lilly로 부터 중국내 판권을 인수한 이노벤트(Innovent)가 진행한 중국 성인대상 당뇨 임상3상(DREAM-2)에서 마즈두타이드(Mazdutide)가 Eli Lilly의 GLP-1 유사체 당뇨병 치료제인 트루리시티(Trulicity, 성분명: dulaglutide)보다 우수한 혈당강하효과를 확인했고, 비만관련 임상3상(GLORY-1)에서도 최대 15.4%의 체중감소효과가 있다고 발표하였다. 또한 마즈두타이드(Mazdutide)는 여러가지 심혈관질환 관련 지표도 개선하는 것으로 나타났다. 이러한 결과를 바탕으로 이노벤트는 마즈두타이드(Mazdutide)를 중국 국가약품감독관리국(NMPA)에 당뇨 및 비만치료제로 사용 승인신청을 하였다.
중국을 제외한 글로벌 권리를 가지고 있는 Eli Lilly도 별도로 비만/당뇨관련 여러 건의 임상 3상을 진행하고 있다.
마즈두타이드(Mazdutide)가 사용승인을 받게되면 최초의 GLP-1R/Glucagon 이중 작용제 비만/당뇨 치료제가 될 것이다.
마즈두타이드(Mazdutide)는 34개의 아미노산으로 구성된 peptide 약제로 주 1회 접종하는 주사제로 개발 중이다.
- 2030년 예상 매출액: 13억 달러
- 마즈두타이드 (Mazdutide) 화합물 구조: 34개의 아미노산으로 구성된 peptide 약제로, 체내 흡수와 안정성을 높이기 위하여 20번 아미노산인 Lysine의 곁가지 아미노기에 long-chain fatty acid side-chain이 도입되어 있다.
8. 데페모키맙 (Depemokimab)
- 개발사: GSK
- 적응증: 중증 알레르기성 천식 (Severe allergic asthma), 만성 부비동염(Chronic rhinosinusitis, 축농증) 치료용 단일클론 항체. (Long-acting anti IL-5 monoclonal antibody for severe allergic asthma) 6개월마다 접종.
- 작용기전 & 약물유형: 데페모키맙은 인간 인터루킨-5(IL-5, 비용종 조직에 높은 수준으로 존재하며 면역계 관련 염증에서 핵심적인 사이토카인)가 수용체에 결합하는 것을 차단하는 단일클론 항체 (monoclonal antibody that blocks human interleukin-5 (IL-5)) 이다. IL-5와 결합하는 친화력이 높고 반감기를 늘린 지속형 항체이기 때문에 6개월에 한 번만 투여하면 비용종을 수반하는 만성 부비동염 (CRSwNP: chronic rhinosinusitis with nasal polyps, 축농증의 일종)을 치료할 수 있다.
- 2030년 예상 매출액: 12억 달러
9. 펜멘비(Penmenvy). (개발명: GSK-3536819, MenABCWY 백신)
- 개발사: GSK
- 적응증: 침습성 수막구균 감염증 (IMD: Invasive Meningococcal disease) 예방 백신. 수막구균 감염증은 급성 감염병으로 주로 수막염과 패혈증을 일으키는 중증 질환이다. 수막구균 백신은 소아에게 필수적으로 접종하는 백신 중 하나이다.
- 작용기전 & 약물유형: 침습성 수막구균성 질환의 주요 원인인 N.메닌지티디스(Neisseria meningitidis) 박테리아 수막구균 5개 그룹(MenA, B, C, W, Y)을 모두 표적으로 하는 1세대 접합성 5가 백신.
GSK는 이미 보유하고 있는 4가 백신 멘비오(Menveo: A, C, W, Y형 백신)와 백세로(Bexsero: B형 백신)를 결합한 5가 백신 MenABCWY를 FDA에 사용승인 신청하였고 2025년 2월15일 드디어 사용승인을 받았다. 상품명은 펜멘비(Penmenvy). 6개월 간격으로 2회 근육주사. 화이자(Pfizer)가 2023년에 승인받은 5가 백신 펜브라야(Penbraya)와 경쟁하게 될 것으로 예상.
- 2030년 예상 매출액: 12억 달러
10. 니포칼리맙 (Nipocalimab)
- 개발사: 존슨앤존슨 (J&J, Johnson & Johnson)
- 적응증: 중증 근무력증(Myasthenia gravis) 및 기타 자가면역질환
- 작용기전 및 약물유형: J&J가 2020년 65억 달러에 모멘타제약(Momenta Pharmaceuticals)을 인수하며 확보. FcRn 수용체와 결합하는 항FcRn 단일클론항체약물(anti-FcRn monoclonal antibody)로서 여러 가지 자가면역질환을 유발하는 IgG 항체 수치만 선택적으로 낮추어 자가면역 반응을 억제하고 신경과 근육간의 신호전달을 개선한다.
2024년 11월 FDA의 혁신신약지정(Breakthrough Therapy designation) 및 2025년 1월 우선심사(priority review) 지정을 받아서 승인심사가 진행 중이다.
- 2030년 예상 매출액: 12억 달러
작성 이현규(한국화학연구원)
참고자료
2025 Preview: What does the year ahead hold for pharma? | Evaluate (바로가기)