뉴스정보
New FDA Approval : Deuterated drug, Deucravacitinib (Sotyktu)
작성자
관리자
작성일
2022-11-02 11:43
조회
1630
New FDA Approval : Deuterated drug, Deucravacitinib (Sotyktu), a First-In-Class Oral, Allosteric Tyrosine Kinase 2 (TYK2) Inhibitor
“약물에 CH3 group 대신에 CD3 group 도입을 고려해 보세요.”
Hydrogen (H) 대신에 Deuterium (D) 이 도입된 TYK2 inhibitor, Deucravacitinib (Sotyktu)이 moderate to severe psoriasis 환자에 대하여 2022년 9월 FDA의 판매허가를 취득했다 (Bristol Myers Squibb). 이 약제는 first-in-class oral, allosteric TYK2 inhibitor로서 JAK1, JAK2, JAK3에 대하여 선택성이 매우 높아 특별한 부작용은 나타내지 않았다고 보고되었다.
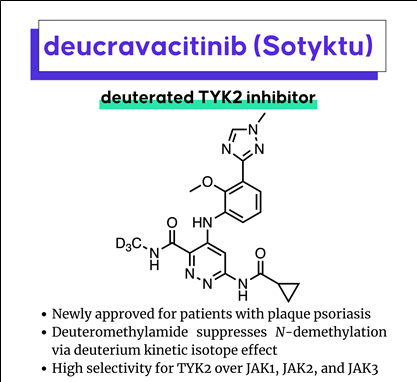
Deucravacitinib (Sotyktu)의 특징
- First de novo deuterated drug
- First-in-class oral, “allosteric” TYK2 inhibitor
- High selectivity for TYK2 over JAK1, JAK2, and JAK3
- Forecasted global sales over US$2.8 billion by 2028
화학적으로 탄소-수소(C-H bond) 결합에너지보다 탄소-중수소(C-D bond) 결합에너지가 높기 때문에 C-D 결합이 포함된 약물은 체내에서의 대사가 느려져 약물의 half-life를 늘리거나 toxic 또는 non-selective metabolites의 생성이 줄어들 수 있다 (deuterium-induced “metabolic shunting”). 실제로 Deucravacitinib 개발자들은 초기에 CH3 group이 도입된 화합물을 만들어서 실험한 결과 CH3 group이 쉽게 대사되어서 non-selective & toxic metabolites가 생성되었고 이를 극복하기 위하여 CH3 대신 CD3 group을 도입한 화합물을 합성하여 mouse 실험을 진행한 결과 CH3 의 경우 3% 였던 non-selective metabolites 생성이 CD3 도입된 화합물의 경우 검출되지 않는다는 것을 확인하였다.
약물에 deuterium (D)이 도입된 deuterated drug의 개발방법은 크게 두가지 방법이 알려져 있다.
(1) deuterium switch : 기존 약물의 구조에서 hydrogen을 deuterium으로 치환(swapping) 하거나,
(2) de novo 합성 : 초기 약물 디자인에서부터 deuterium을 포함하여 개발을 진행하는 방법이 있다.
Deucravacitinib은 FDA 허가를 받은 최초의 “de novo” deuterated drug 이다. 최초의 "deuterium-switched drug"은 2017년 FDA허가를 받은 Teva Pharmaceutical의 vesicular amine transporter 2 (VMAT2) inhibitor인 Deuteterabenazine(Austedo) 이다. Deuteterabenazine(바로가기) 는 chorea associated with Huntington's disease 치료제로 2008년 FDA의 허가를 받아서 판매되고 있는 Tetrabenazine(Xenazine) 구조에서 2개의 CH3O group을 CD3O group으로 변경한 약물이다. Deuteterabenazine(Austedo)은 Tetrabenazine(Xenazine)에 비하여 half-life 와 safety profile이 개선되었다고 보고되어 있다.
작성 : 이현규 (한국화합물은행)
<관련문헌 바로가기>Nature Review Drug Discovery, volume 21, September 2022, 623.
Org. Process Res. Dev. 2022, 26, 1202.